Volumen 38, Nº 1 | 2020
Triptófano en Enfermedad Inflamatoria Intestinal - The content of tryptophan in the diet influences disease activity on Inflammatory Bowel Disease
Leonela Tantucci, Dafne Cabrera, Marina L. Fernández, Marina Cabanillas, Adriana Fochesato, Andrea Delgado, Silvia G. Correa, Domingo C. Balderramo y Pablo A. Romagnoli
Palabras clave: Dieta, Triptófano, Metabolitos, Microbiota, Enfermedad Inflamatoria Intestinal
Keywords: Diet, Tryptophan, Metabolites, Microbiota, Inflammatory Bowel Disease
INTRODUCCIÓN
La superficie de la mucosa intestinal se encuentra continuamente expuesta a bacterias que forman parte de la microbiota e inciden en el desarrollo de todo el sistema inmune a través de interacciones con el epitelio intestinal (1). El influjo continuo de nutrientes proveniente de la dieta, resulta en la formación de metabolitos que impactan en las células de la mucosa intestinal modulando respuestas inmunes no sólo en tejidos locales (2), sino también en tejidos distantes como el sistema nervioso (3). En particular, los metabolitos derivados del triptófano dietario generados por la microbiota promueven la homeostasis de la barrera intestinal (4, 5) aunque el entendimiento de cómo lo hacen es incompleto.
El triptófano que proviene de la digestión de las proteínas de la dieta es catabolizado por la microbiota intestinal en metabolitos como los indoles y sus derivados (6). Estos metabolitos son considerados ligandos tanto del receptor de radicales de arilo (AhR) (4) como del receptor de pregnano X (PXR) (5). Estos receptores una vez activados inducen la producción de IL-22, una citoquina que mantiene la homeostasis intestinal promoviendo la defensa inmune y la reparación de los tejidos (7). Esto sugeriría que una disponibilidad reducida del triptófano dietario en la interfaz de la mucosa podría resultar en una menor formación de derivados de indol a través de la microbiota, lo que a su vez alteraría la activación de AhR o PXR y la secreción de IL-22 ocasionando un aumento de permeabilidad de la barrera intestinal (8). Es por ello que resulta relevante entender cuál es la influencia del triptófano dietario en el estado de salud intestinal de las personas.
La desregulación de la barrera intestinal está fuertemente asociada al desarrollo de enfermedades inflamatorias intestinales (EII) tales como la enfermedad de Crohn (EC) y la colitis ulcerosa (CU) (9, 10). Aunque la etiopatogenia de las mismas es actualmente desconocida, la hipótesis más aceptada es que las interacciones complejas entre los factores genéticos, ambientales y microbianos desencadenan alteraciones en las respuestas inmunes que resultan en una inflamación intestinal crónica (11). A partir del siglo XX la incidencia y prevalencia de las EII aumentó en los países occidentales, principalmente en el norte de Europa y Canadá (12). Esta tendencia también ha impactado en Asia y en los países en desarrollo donde hasta hace 20 años estaba ausente (13). Esto hace pensar, que el estilo de vida sedentario sumado a los alimentos de bajo costo y altos en calorías podrían ser cofactores importantes en la etiología de la EII (14). Debido a esto, modificar la dieta se ha convertido en una novedosa propuesta tanto para la prevención como para el tratamiento de la EII (15).
El perfil metabólico de un paciente refleja tanto la composición de la microbiota como los nutrientes presentes en su dieta. Definir los mecanismos de acción de ciertos metabolitos dietarios representa una gran oportunidad para poder manipular la respuesta inmune en ciertos procesos patológicos para los cuales aún no hay terapias efectivas. En este trabajo estudiamos el contenido de triptófano en la dieta diaria, los niveles séricos de este aminoácido esencial y la presencia de metabolitos en orina de pacientes con distintos estadios de EII con el objetivo de evaluar la hipótesis de que los metabolitos de triptófano dietario influyen en las respuestas inmunes de la mucosa intestinal y por ende en la actividad de las EII.
MATERIALES Y MÉTODOS
Población de estudio: Este estudio clínico de corte transversal se llevó a cabo con pacientes reclutados por el servicio de Gastroenterología del Hospital Privado Centro Médico de Córdoba S.A. (HPCMC) según los siguientes criterios:
-Criterios de Inclusión:
a) Grupo de pacientes con EII: Pacientes de edad superior a 18 años con diagnóstico de EII definida por criterios clínicos, radiológicos y endoscópicos. A los pacientes se les explicó sobre su participación en el estudio y se les proporcionó un consentimiento informado para firmar.
b) Grupo control: Pacientes mayores de 18 años sin antecedentes de EII, u otra patología activa del tracto digestivo diagnosticada durante los 6 meses previos (ej. hemorragia digestiva, gastroenteritis, diverticulitis).
-Criterios de Exclusión: Embarazo, tratamiento antibiótico mayor de 7 días los 2 meses previos a la inclusión, cirugía abdominal dentro de los 6 meses previos, presencia de neoplasia en cualquier localización.
Este estudio fue aprobado por el Departamento de Docencia e Investigación del HPCMC y luego por el Comité Institucional de Ética de la Investigación en Salud del HPCMC. Todos los participantes de este estudio firmaron el consentimiento informado correspondiente.
Manejo de Muestras: Las muestras de sangre (plasma con EDTA) y orina (muestra aislada) de cada paciente codificados con números y letras fueron almacenadas en freezer -20 °C en la Unidad de Enfermedades Inflamatorias Intestinales del Centro de Investigaciones en Medicina Traslacional “Severo Amuchástegui” (CIMETSA) del Instituto Universitario de Ciencias Biomédicas (IUCBC).
Encuesta alimentaria: Los pacientes seleccionados completaron una encuesta alimentaria de forma prospectiva, detallando todos los alimentos consumidos en el transcurso del día, durante una semana. Para lo cual, la nutricionista, a cargo del estudio, les explicó cómo llevar a cabo el registro, para que pudieran hacerlo de forma correcta. El consumo diario de triptófano se calculó usando una herramienta del sitio MyFoodData.com que compila las bases de datos del Departamento de Agricultura de Estados Unidos de América (15).
Medición de triptófano por HPLC: Para medir los niveles de triptófano en sangre se optimizó y validó una técnica cromatográfica con alta sensibilidad y especificidad (16) en el Laboratorio de la Fundación Para el Pro HPCMC greso de la Medicina. Brevemente, se utilizó un cromatógrafo líquido de alta resolución (HPLC) Agilent Technologies 1260 Infinity con detector de rearreglo de diodos. La separación cromatográfica se realizó en columna Eclipse XDB-C18.5 μm y 4.6 x 250 mm de Agilent Technologies. Se utilizó ácido perclórico calidad analítica como agente desproteinizante en el pre tratamiento del plasma y como estándar interno Tiramina. Se trabajó con una fase móvil de composición Buffer Acetato (pH=4.5) -Acetonitrilo, con un flujo isocrático de 1 ml/min. Los datos fueron recolectados mediante el software ChemStation y analizados a 280 nm del espectro.
Perfil metabólico urinario: El perfil metabólico urinario de los participantes de este estudio fue medido según ha sido reportado previamente (17). Las muestras de orina fueron tomadas por la mañana, alicuotadas y almacenadas en freezer -20 °C. Se determinaron los niveles de creatinina para correlacionar la excreción de ácidos orgánicos con el volumen de orina correspondiente a 100 μg de creatinina. Ácido undecanedoico fue agregado a la muestra de orina como estándar interno. Los alfa cetoácidos fueron oximados a 80 °C por 30 min usando hidroxilamina y el pH fue ajustado a 14.0 usando hidróxido de sodio. Para favorecer la extracción de ácidos orgánicos de cadena corta, el pH fue ajustado a 2.0 usando ácido hidroclórico. La extracción liquida-líquida se realizó dos veces usando acetato de etilo, tomando la fase orgánica para ser evaporada mediante corriente de nitrógeno. La reacción de derivatización para obtener derivados volátiles de trimetilsilil fue hecha a 60°C durante una hora agregando 50 μl de N,O- bis(trimethylsilyl)trifluoroacetamide- trimethylchlorosilane) (BSTFA) y 50 μl de acetonitrilo.
Cromatografía gaseosa acoplada a detector de masa: Las muestras fueron inyectadas en el sistema de cromatografía gaseosa Clarus SQ 580 (Perkin Elmer, USA) usando un inyector automático. Se utilizó una columna Agilent J&W DB-5 (Agilent, Santa Clara, CA, USA), de 30 m de largo, 0,25 mm de diámetro interno y un espesor del film de 0,25 mm. Las muestras fueron inyectadas en modo split usando un volumen de inyección de 1 μl con una fracción de split de 1:25. La temperatura del inyector fue de 275°C, la fuente iónica fue de 230°C y el cuadrupolo estuvo a 130°C. La temperatura inicial fue de 70°C, se mantuvo por 5 min, subiendo 4,5° C/min hasta una temperatura final de 300° C con un tiempo de corrida total de 61.0 min. La ionización se realizó con un modo de impacto electrónico, determinando el espectro de masa cada 0,25 s en el intervalo entre 50 y 480 m/z. Para el análisis de los metabolitos detectados fueron utilizados Total Chrome 6.3.1 (Perkin Elmer) y TurboMass 5.4.2 (Perkin Elmer). El análisis bioinformático de los datos fue realizado usando Morpheus (Broad Institute, Boston, MA, USA) (18).
-Estadio clínico de la EII en pacientes: El estadio clínico de los pacientes con EII fue calculado usando los índices de actividad de enfermedad Mayo (19) para CU y los índices de Harvey-Bradshaw (20) para EC.
Análisis estadístico. El análisis estadístico de nuestros resultados fue realizado usando Prism (GraphPad, San Diego, CA, USA). Los métodos utilizados fueron: Shapiro-Wilk para la normalidad de los datos, ANOVA de una vía con análisis posterior para comparación de grupos usando el método de Tukey y para la medición de correlación entre valores se utilizo la correlación de Pearson.
RESULTADOS
El contenido de triptófano consumido y plasmático es comparable entre controles y pacientes con EII.
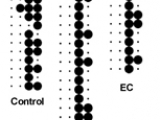
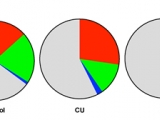
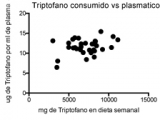
Este estudio fue llevado a cabo en 36 participantes, de los cuales 11 correspondieron al grupo control, 15 pacientes con CU y 10 pacientes con EC catalogados según el Servicio de Gastroenterología del HPCMC. 25 participantes fueron del sexo femenino y 11 del sexo masculino, con un rango de edades comprendidos entre 22 y 73 años y una edad media de 40 años. Para validar los valores de triptófano estimados en las encuestas, se compararon los patrones alimentarios y nutricionales entre participantes evaluando el cumplimiento de los mensajes 3, 6, 7 y 8 establecidos por Guías Alimentarias para la Población Argentina (GAPA) en cada participante (21) (Figurar 1a). El mensaje fue considerado cumplimentado o no por el participante si lo hizo durante 4 de los 7 días encuestados (círculo negro). Caso contrario, fue considerado como no cumplimentado (punto). La adherencia al mensaje 3 de las GAPA (Figura 1a, primera columna) fue nula para todos los grupos estudiados, en tanto que solo un participante de todos los encuestados cumplimentó con el mensaje 6 (Figura 1a, segunda columna). Es decir, fue escasa la incorporación de las porciones aconsejadas de frutas, verduras y lácteos por día. Por el contrario, la mayoría de los participantes consumió carnes según lo requerido por el mensaje 7 (Figura 1a, tercera columna). En cuanto al mensaje 8 (Figura 1a, cuarta columna), gran parte de la población estudiada consumió cereales y legumbres. Sin embargo, como se consideró la variedad de legumbres consumida, el cumplimiento observado fue esporádico para cada grupo del estudio. En líneas generales, los comportamientos alimentarios y nutricionales entre los grupos fueron equivalentes. Además, en base a la misma encuesta, se pudo percibir que los pacientes en estudio tienen similares patrones dietéticos ricos en triptófano con un consumo relativo de alimentos ricos en este aminoácido como carnes, lácteos y granos que fue comparable entre grupos (Figura 1b). La única diferencia significativa se observó entre los niveles relativos de carnes entre los grupos control y los pacientes con CU. Sin embargo, de manera interesante para nuestra hipótesis, no hubo diferencias significativas en el triptófano consumido estimado (Figura 1c) ni en los niveles de triptófano plasmáticos medidos por HPLC que permanecieron estables en todos los grupos (Figura 1d). Además, se determinó una baja correlación entre la cantidad de triptófano consumida y los niveles de triptófano biodisponibles (Figura 1e, r=0,3165).
Perfiles de metabolitos en orina reflejan el estado de la microbiota y el metabolismo en la EII.
Los perfiles metabólicos en orina reflejan tanto la composición de la microbiota como el estado metabólico del organismo (22). En un estudio preliminar, analizamos 3 muestras representativas de cada grupo en base a la actividad de la EII usando cromatografía gaseosa y espectrometría de masa. El análisis bioinformático permitió determinar patrones complejos de presencia, ausencia o distintos niveles que caracterizan a cada grupo (Figura 2a). En base al estudio metabolómico, evaluamos si las estimaciones de la cantidad de triptófano consumida a través de encuestas tenían relación con los metabolitos del triptófano presentes en orina. Encontramos una alta correlación entre los valores del metabolito derivado del triptófano 1H-indol-2,3-diona y los del triptófano consumidos estimados (Figura 2b, r=0,7631, p=0,0168). Por otro lado, el estudio preliminar mostró cambios en la concentración de metabolitos no derivados del triptófano como ácido cítrico y 2-hidroxibutirico en pacientes con EII con respecto a los controles (Figura 2 c y d).
La cantidad de triptófano consumido esta relacionada al estadío de la EII en pacientes con EC
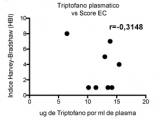
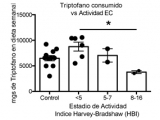
Para evaluar si la cantidad de triptófano consumido o en circulación tiene alguna relación con el estadío de la EII, se representó el contenido de triptófano en dieta o plasma en función de la actividad de la enfermedad evaluada con el score Mayo para pacientes con CU y el índice de Harvey Bradshaw (HBI) para pacientes con EC. Mientras que en CU los niveles de triptófano (consumido y circulante) no se correlacionan con el estadio de la enfermedad (Figura 3a y b), en pacientes con EC activa estos niveles fueron más bajos (Figura 3c y 3d). En particular, los niveles de triptófano consumido mostraron una correlación negativa significativa con el Índice HBI (Figura 3c, r=-0,6971, p=0,0251) con una disminución significativa en aquellos pacientes con índices HBI de 8-16 (Figura 3e).
DISCUSION
En este estudio se evaluó en grupos de pacientes con EII y en un grupo control, el contenido de triptófano en dieta, los valores de triptófano en circulación, los metabolitos de triptófano en orina y su relación con el estadío de la EII. La cantidad de triptófano presente en la dieta estimada usando una encuesta de 7 días estuvo significativamente relacionada con los valores del metabolito de triptófano 1H-indol-2,3-diona cuantificados por cromatografía gaseosa y espectrometría de masa en orina. En efecto, los niveles de triptófano libre en el organismo están determinados por la relación entre la ingesta de alimentos y la actividad de distintas vías metabólicas; sólo una pequeña fracción de triptófano libre es utilizado para la síntesis de proteínas y la producción de neurotransmisores y más del 95% es sustrato para la degradación que genera varios metabolitos con distintas actividades biológicas (23).
En principio, nuestro hallazgo principal sugiere una asociación entre el estadio de la EII en los pacientes con EC y la cantidad de triptófano consumido. En este sentido, si bien varias publicaciones han descripto alteraciones en el metabolismo de triptófano intestinal en EII (24), nuestros resultados confieren validez a la cantidad de triptófano consumida y plantean la posibilidad de que aumentando la cantidad de triptófano consumido se pueda disminuir la actividad de la EII en pacientes con EC.
En concordancia con datos obtenidos en modelos de inflamación en animales (25), nuestro estudio además muestra cambios en metabolitos que denotan alteraciones en el metabolismo energético y en el estrés oxidativo. Aunque la disminución de ácido cítrico en orina de pacientes con EII no ha sido reportada previamente, en biopsias de mucosa de pacientes con CU se detectó una disminución de acido cítrico (26), lo que produciría una consecuente menor excreción en orina. Por otro lado, el aumento del metabolito 2-hidroxibutirico en orina está asociado a estrés oxidativo o detoxificación de compuestos xenobióticos que causan un aumento de síntesis de glutatión (27). El aumento de este metabolito en orina es indicativo de estrés metabólico crónico y ha sido encontrado recientemente en niveles aumentados en orina de pacientes pediátricos con EII (28). Los resultados preliminares del análisis de muestras representativas de cada grupo de nuestro estudio permiten suponer que el perfil metabolómico de los pacientes con EII puede proporcionar herramientas para mejorar la calidad de vida y las complicaciones evolutivas de dichos pacientes.
CONCLUSION
Nuestros resultados aportan una evidencia significativa en cuanto al rol del metabolismo del triptófano en las EII en nuestro medio y sientan las bases para una nueva herramienta de medicina de precisión en el manejo de la EII para mejorar la calidad de vida y desarrollar nuevas terapias que puedan inducir la reparación de la mucosa intestinal de estos pacientes.
CONFLICTOS DE INTERESES
Los autores declaran no tener conflicto de intereses.
AGRADECIMIENTOS
Financiamiento: Fondos aportados por Fundación para el Progreso de la Medicina, Centro de Investigaciones en Bioquímica Clínica e Inmunología (CIBICI) de la Facultad de Ciencias Quimicas (FCQ) de la Universidad Nacional de Cordoba (UNC) y Centro de Investigaciones en Medicina Traslacional “Severo Amuchástegui” (CIMETSA) del Instituto Universitario de Ciencias Biomédicas (IUCBC) a través de la Fundación Innova T - Delegación Córdoba, Unidad de Vinculación Tecnológica del CONICET.
Bibliografía
1. Macpherson AJ, Harris NL. Interactions between commensal intestinal bacteria and the immune system. Nature reviews 2004;4:478-85.2. Ivanov II, Atarashi K, Manel N, Brodie EL, Shima T, Karaoz U, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell 2009;139:485-98.
3. Rothhammer V, Mascanfroni ID, Bunse L, Takenaka MC, Kenison JE, Mayo L, et al. Type I interferons and microbial metabolites of tryptophan modulate astrocyte activity and central nervous system inflammation via the aryl hydrocarbon receptor. Nature medicine 2016;22:586-97.
4. Lamas B, Richard ML, Leducq V, Pham HP, Michel ML, Da Costa G, et al. CARD9 impacts colitis by altering gut microbiota metabolism of tryptophan into aryl hydrocarbon receptor ligands. Nature medicine 2016;22:598-605.
5. Venkatesh M, Mukherjee S, Wang H, Li H, Sun K, Benechet AP, et al. Symbiotic bacterial metabolites regulate gastrointestinal barrier function via the xenobiotic sensor PXR and Toll-like receptor 4. Immunity 2014;41:296-310.
6. Roager HM, Licht TR. Microbial tryptophan catabolites in health and disease. Nature communications 2018;9:3294.
7. Zelante T, Iannitti RG, Cunha C, De Luca A, Giovannini G, Pieraccini G, et al. Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22. Immunity 2013;39:372-85.
8. Konig J, Wells J, Cani PD, García-Ródenas CL, MacDonald T, Mercenier A, et al. Human Intestinal Barrier Function in Health and Disease. Clin Transl Gastroenterol 2016;7:e196.
9. Ungaro R, Mehandru S, Allen PB, Peyrin-Biroulet L, Colombel JF. Ulcerative colitis. Lancet 2017;389:1756-70.
10. Torres J, Mehandru S, Colombel JF, Peyrin-Biroulet L. Crohn's disease. Lancet 2017;389:1741-55.
11. Podolsky DK. Inflammatory bowel disease. N Engl J Med 2002;347:417-29.
12. Benchimol EI, Manuel DG, Guttmann A, Nguyen GC, Mojaverian N, Quach P, et al. Changing age demographics of inflammatory bowel disease in Ontario, Canada: a population-based cohort study of epidemiology trends. Inflammatory bowel diseases 2014;20:1761-9.
13. RD V. Epidemiology of inflammatory bowel disease (IBD):Why are there differences between North America and Latin America? Rev Col Gastroenterol 2010;25:103-5.
14. Devkota S, Chang EB. Interactions between Diet, Bile Acid Metabolism, Gut Microbiota, and Inflammatory Bowel Diseases. Dig Dis 2015;33:351-6.
15. USDA (MyFoodData.com. https://tools.myfooddata.com/protein-calculator.php.
16. Zhen Q, Zhen Q, Xu B, Ma L, Tian G, Tang X, Ding M. Simultaneous determination of tryptophan, kynurenine and 5-hydroxytryptamine by HPLC: Application in uremic patients undergoing hemodialysis. Clin Biochem 2011;44:226-30.
17. Tanaka K, Hine DG, West-Dull A, Lynn TB. Gas-chromatographic method of analysis for urinary organic acids. I. Retention indices of 155 metabolically important compounds. Clin Chem 1980;26:1839-46.
18. Institute B (Morpheus. https://software.broadinstitute.org/morpheus.
19. Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalicylic acid therapy for mildly to moderately active ulcerative colitis. A randomized study. N Engl J Med 1987;317:1625-9.
20. Harvey RF, Bradshaw JM. A simple index of Crohn's-disease activity. Lancet 1987;1:514.
21. Nacion MdSdl (2016) Guías Alimentarias para la Población Argentina (GAPA) (Ministerio de Salud de la Nacion, Buenos Aires), Ministerio de Salud de la Nacion, Republica Argentina.
22. Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, et al. Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites. Proceedings of the National Academy of Sciences of the United States of America 2009;106:3698-703.
23. Platten M, Nollen EAA, Rohrig UF, Fallarino F, Opitz CA. Tryptophan metabolism as a common therapeutic target in cancer, neurodegeneration and beyond. Nat Rev Drug Discov 2009;18:379-401.
24. Agus A, Planchais J, Sokol H. Gut Microbiota Regulation of Tryptophan Metabolism in Health and Disease. Cell host & microbe 2018;23:716-24.
25. Dong F, Zhang L, Hao F, Tang H, Wang Y. Systemic responses of mice to dextran sulfate sodium-induced acute ulcerative colitis using 1H NMR spectroscopy. J Proteome Res 2013;12:2958-66.
26. Ooi M, Nishiumi S, Yoshie T, Shiomi Y, Kohashi M, Fukunaga K, et al. GC/MS-based profiling of amino acids and TCA cycle-related molecules in ulcerative colitis. Inflamm Res 2011;60:831-40.
27. Selen ES, Bolandnazar Z, Tonelli M, Bütz DE, Haviland JA, Porter WP. NMR Metabolomics Show Evidence for Mitochondrial Oxidative Stress in a Mouse Model of Polycystic Ovary Syndrome. J Proteome Res 2015;14:3284-91.
28. Martin FP, Su MM, Xie GX, Guiraud SP, Kussmann M, Godin JP, et al. Urinary metabolic insights into host-gut microbial interactions in healthy and IBD children. World J Gastroenterol 2017;23:3643-54.
Imágenes

Figura 2a: Perfiles de metabolitos en orina reflejan el estadio de disbiosis de la Enfermedad Inflamatoria Intestinal.
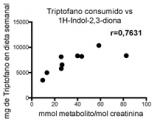
Figura 2b: Perfiles de metabolitos en orina reflejan el estadio de disbiosis de la Enfermedad Inflamatoria Intestinal.
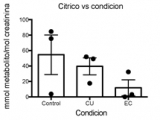
Figura 2c: Perfiles de metabolitos en orina reflejan el estadio de disbiosis de la Enfermedad Inflamatoria Intestinal.
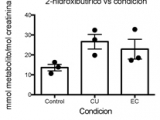
Figura 2d: Perfiles de metabolitos en orina reflejan el estadio de disbiosis de la Enfermedad Inflamatoria Intestinal.
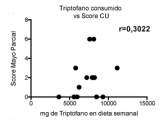
Figura 3a: La cantidad de triptófano en dieta correlaciona con la actividad de la Enfermedad de Crohn.
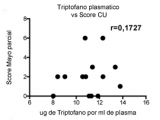
Figura 3b: La cantidad de triptófano en dieta correlaciona con la actividad de la Enfermedad de Crohn.
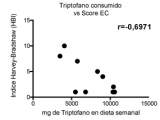
Figura 3c: La cantidad de triptófano en dieta correlaciona con la actividad de la Enfermedad de Crohn.