Volumen 38, Nº 1 | 2020
Síndrome de Sjögren primario - Immunological phenotype of primary Sjögren's síndrome
Soledad Retamozo, Santiago Scarafia, Eduardo Cuestas, Manuel Ramos-Casals, Pilar Brito-Zerón
Palabras clave: síndrome de Sjögren primario, fenotipo, inmunología, anticuerpos
Keywords: Primary Sjögren sindrome, fenotype, immunology, antibodies
INTRODUCCIÓN
El síndrome de Sjögren primario (SSp) es una enfermedad autoinmune sistémica compleja. La inflamación inmunomediada causa disfunción glandular secretora, que conduce a la sequedad de las principales superficies mucosas (1). Aunque se desconoce la etiopatogenia de la enfermedad, la hipótesis principal se basa en el efecto de múltiples factores ambientales, principalmente desconocidos, en un individuo con una susceptibilidad genética específica. La enfermedad afecta principalmente a mujeres de mediana edad, pero también a niños, hombres y ancianos. Y a pesar de que los síntomas de sequedad se encuentran entre las manifestaciones oculares y orales más frecuentemente observadas por los médicos de cabecera, la enfermedad a menudo se diagnostica de manera insuficiente o errónea. Más allá del síndrome sicca, el SSp puede ser una enfermedad grave, con una elevada mortalidad principalmente debido a la enfermedad sistémica y al cáncer hematológico. La presentación es variable y a menudo vinculada a la influencia de múltiples determinantes individuales que pueden dar lugar a retrasos en el diagnóstico de hasta 10 años en pacientes que a menudo visitan a varios especialistas (2).
En esta revisión, analizamos los principales determinantes inmunológicos involucrados en la expresión fenotípica del SSp, subyacente a la importancia de caracterizar a las enfermedades autoinmunes complejas para ofrecer un medicamento personalizado y más efectivo.
FENOTIPO DEL PACIENTE DOBLE POSITIVO ANTI-RO/LA
En la cohorte internacional del Big Data International Project, el 45% de los pacientes tenían anticuerpos anti-La, asociados principalmente con la presencia concomitante de anticuerpos anti-Ro (95% de los casos) (3). Probablemente por esta razón, el fenotipo de los portadores del anti-La fue muy similar al descripto para los portadores del anti-Ro. Sin embargo, pocos estudios han analizado si el fenotipo de la enfermedad de los portadores de Ro+ está influenciado por la presencia concomitante o no de anticuerpos anti-La. Locht y cols (4) informaron una mayor frecuencia de afectación de órganos internos en pacientes portadores de anti-La y anti-Ro en comparación con aquellos que solamente tenían anti-Ro+; resultados similares también se han encontrado en otros estudios (5,6). Desafortunadamente, un estudio reciente publicado por Baer y cols. no compara el anti-Ro/La + versus el anti-Ro aislado (7). En la cohorte del Big Data, cuando analizamos el fenotipo de pacientes con anti-Ro/La según las diferentes combinaciones de anticuerpos, encontramos que las diferencias fenotípicas más notables estaban en los pacientes que tenían los dos anticuerpos positivos en comparación con aquellos que tenían un solo anticuerpo (8).
FENOTIPO DEL PACIENTE PORTADOR DE ANTI-RO AISLADO
Los anticuerpos anti-Ro, están presentes en el 70-80% de los pacientes, y son los marcadores inmunológicos clave del SSp. En casi el 10-20% de los pacientes con anticuerpos anti-Ro, el anticuerpo antinuclear (ANA) puede ser negativo (9) y los anticuerpos anti-Ro pueden estar presentes muchos años antes del inicio de los síntomas o del diagnóstico del SSp (SS temprano) (10). En la cohorte del Big Data, encontramos anticuerpos anti-Ro en el 73% de nuestros pacientes, una cifra muy cercana a la encontrada para el ANA (3). Varios estudios han correlacionado la presencia del anti-Ro con la mayoría de las características sistémicas e inmunológicas relacionadas con el SSp (11). Un estudio reciente de Quartuccio y cols. comparó pacientes con Ro/La + versus Ro/La- (12), en donde se encontró que aquellos que tenían ambos anticuerpos positivos eran más jóvenes al momento del diagnóstico, tenían una mayor frecuencia de características sistémicas, de marcadores inmunológicos y de linfoma. Mientras que recientemente el estudio multicéntrico español encontró que los anticuerpos anti-Ro al momento del diagnóstico también se correlacionaron con una mayor puntuación de la actividad del ESSDAI (EULAR Sjögren's syndrome disease activity index) en los dominios articular, cutáneo y renal (13). También hemos confirmado un fenotipo Ro específico en la cohorte internacional del Big Data caracterizado por pacientes diagnosticados a edades más tempranas, con una menor frecuencia del síndrome sicca y de biopsia positiva de la glándula salival, y una mayor frecuencia de la actividad en los dominios del ESSDAI a nivel constitucional, cutáneo y del laboratorio.
FENOTIPO DEL PACIENTE PORTADOR DE ANTI-LA AISLADO
Un reciente interés en caracterizar a los pacientes con SSp que tienen autoanticuerpos La aislados ha surgido después de la exclusión de este subconjunto de pacientes de los criterios de clasificación americanos/europeos recientemente propuestos (14). Esta exclusión se basó en el manuscrito publicado por Baer y cols. (7), en donde en la cohorte SICCA (Sjögren's International Collaborative Clinical Alliance) encontraron que estos pacientes tenían una menor frecuencia de positividad en las tinciones oculares y un menor puntaje de focos en las glándulas salivales en comparación con los pacientes portadores de Ro+ (con o sin La asociados). Sin embargo, los portadores aislados de La también mostraron una mayor frecuencia de sequedad de boca, una prueba de Schirmer media más alta y una mayor frecuencia de resultados anormales del flujo salival total no estimulado que el grupo seronegativo, lo que sugiere que los pacientes con anti-La aislado pueden tener un fenotipo intermedio entre los pacientes Ro+ y Ro- con SSp relacionados con la afectación glandular. Otros dos estudios han analizado el fenotipo de los portadores de La aislados, incluida la afectación sistémica, aunque la comparación con el estudio de Baer no es sencilla, ya que estos estudios incluyeron pacientes que cumplían los criterios del año 2002 (solo la mitad de los participantes en la cohorte SICCA cumplían con los criterios clasificatorios del año 2002/2012). El primer estudio fue publicado por Danda y cols. en pacientes estadounidenses con SSp (15). Este estudio no encontró diferencias significativas, especialmente en los resultados de las pruebas de diagnóstico de la enfermedad. En edades más tempranas al momento del diagnóstico, encontró una menor frecuencia de biopsia salival positiva, del factor reumatoideo (FR) positivo y en la actividad sistémica entre los portadores de anticuerpos La aislados y portadores Ro+. El segundo estudio se realizó en la cohorte internacional del Big Data, en donde se confirmó la mayoría de los resultados informados por Danda y cols. En comparación con los pacientes seronegativos diagnosticados por biopsia, los portadores aislados de La tenían una edad de diagnóstico 5,5 años menor, con una menor frecuencia de sequedad oral pero una frecuencia significativamente mayor de pruebas de diagnóstico orales anormales, mientras que con respecto a los portadores Ro+, los portadores aislados de La mostraron una mayor frecuencia de sequedad ocular, una menor frecuencia de biopsia positiva de glándulas salivales menores y una frecuencia significativamente menor de ANA, FR, hipocomplementemia y de crioglobulinemia. En la cohorte más grande de pacientes con SSp que cumple con los criterios de clasificación americano/europeos del año 2002, solo el 3% de los pacientes tenían anticuerpos anti-La/SS-B aislados. Este pequeño subconjunto de pacientes tenía un perfil clínico e inmunológico específico que combinaba algunas características tanto de pacientes seronegativos como de pacientes que tenían anticuerpos anti-Ro/SS-A. Al no existir una prueba de diagnóstico patognomónica, el estándar de oro para el diagnóstico clínico del SSp sigue siendo la opinión de los expertos, y estamos de acuerdo con Danda y cols.: el mejor diagnóstico para este subconjunto de pacientes es clínico; sin embargo, y para los ensayos clínicos donde las poblaciones homogéneas son deseables, estos pacientes probablemente podrían ser excluidos o analizados por separado (15). El papel central etiopatogénico del autoantígeno La en el SSp, confirmado por varios estudios publicados en los últimos 20 años, también apoya la inclusión de los autoanticuerpos La en el espectro inmunológico típico del SSp (16-20).
FENOTIPO DEL PACIENTE CON CRIOGLOBULINEMIA
Hace veinte años, informamos la estrecha asociación entre vasculitis leucocitoclástica cutánea, hipocomplementemia, infección crónica por el virus de la hepatitis C (VHC) y presencia de crioglobulinas en pacientes con SSp (21), y en 2007 demostramos el papel pronóstico clave de las crioglobulinas en pacientes con SSp sin infección por el VHC (22). Desde entonces, varios estudios han confirmado la estrecha asociación entre las crioglobulinas y la enfermedad sistémica (23). Sin embargo, estos estudios solo han analizado la presencia de crioglobulinas séricas (con o sin síntomas) o púrpura/vasculitis (asociada o no a crioglobulinemia). Muchos pacientes con crioglobulinemia permanecen asintomáticos, y el porcentaje que desarrolla vasculitis crioglobulinémica (VC) varía entre el 2% y el 50%, con una expresión variada desde una enfermedad benigna (artralgias y púrpura cutánea no complicada) hasta vasculitis sistémica con elevada mortalidad. En un estudio reciente hemos evaluado el espectro completo de características clínicas e inmunológicas actualmente integradas en la definición de VC, de acuerdo con los criterios de clasificación internacionalmente aceptados (23). En pacientes con SSp y crioglobulinas positivas, la VC estuvo presente en el 35% de los casos (86% en aquellos que cumplían con los criterios de VC en comparación con el 11% en aquellos que no lo hicieron). Hemos confirmado el estrecho vínculo entre la VC y la enfermedad sistémica también en la cohorte del Big Data: los pacientes con VC tenían la mayor frecuencia de actividad en todos los dominios, excepto en dos (muscular y del sistema nervioso central –SNC-), y las puntuaciones medias del ESSDAI fueron 2 veces más altas al diagnóstico y 3 veces mayor al final del seguimiento en comparación con los puntajes de los pacientes que tenían las crioglobulinas negativas. En otro estudio, Quartuccio y cols. informaron que las puntuaciones del ESSDAI y ClinESSDAI fueron significativamente más altas en pacientes con crioglobulinas positivas, especialmente en los dominios constitucional, linfadenopatía, glandular, cutáneo, sistema nervioso periférico y hematológicos (24).
Varios estudios han demostrado que las crioglobulinas son un importante predictor del desarrollo de linfoma en pacientes con SSp (22,25-27). Hemos confirmado la asociación entre la crioglobulinemia y el linfoma, que es una asociación más significativa en pacientes con VC (HR 7,47) que en aquellos sin VC (HR 2,56). Cuantos más marcadores clínicos/inmunológicos relacionados con la VC tenga el paciente con SSp, mayor será el riesgo de linfoma, mientras que los pacientes negativos para crioglobulinas tienen menos probabilidades de desarrollar linfoma (HR 0,39) (23).
Los pacientes con SSp deben ser evaluados al momento del diagnóstico para detectar crioglobulinas, FR, factores del complemento C3/C4 e inmunoelectroforesis sérica, y deben ser evaluados tanto para la actividad sistémica (ESSDAI) como para la vasculitis (cumplimiento de los criterios de la VC), ya que aquellos con VC concomitante al diagnóstico tienen un alto riesgo de desarrollar un resultado adverso.
FENOTIPO DEL PACIENTE CON HIPOCOMPLEMENTEMIA
Junto con las crioglobulinas, la hipocomplementemia es el otro factor pronóstico inmunológico clave en el SSp. Estudios previos en cohortes internacionales multicéntricas informaron una asociación significativa entre los niveles bajos de complemento y las principales características sistémicas del SSp, que incluyen tanto la enfermedad extraglandular (fiebre, afectación articular, vasculitis cutánea y neuropatía periférica) como los marcadores inmunológicos (crioglobulinemia, factor reumatoide) (22,28). Recientemente, Shiboski y cols. (29) también demostraron que los pacientes con sicca e hipocomplementemia tenían 6 veces más probabilidades de progresar a un SSp definitivo. Además, la hipocomplementemia también se asocia estrechamente con el desarrollo y muerte por linfoma (30), aunque hay más estudios que reflejan una asociación mas frecuente con el desarrollo del linfoma para la hipocomplementemia C4 (26,31-35) que para C3 (31,34-36), como asi también hay estudios que se asocian con una supervivencia menor para la hipocomplementemia C4 (22,37–40) que para con C3 (37,39,40).
Ningún estudio ha analizado el papel diferenciado de tener hipocomplementemia C3 o C4 en pacientes con SSp. En la cohorte del Big Data, hemos analizado por separado el fenotipo de pacientes asociado con valores bajos de C4 o valores bajos de C3, y encontramos diferencias significativas. Los pacientes con hipocomplementemia C4 eran mayores y tenían una mayor frecuencia de biopsia salival positiva, mientras que aquellos con hipocomplementemia C3 eran más jóvenes y tenían una menor frecuencia de síntomas de sequedad. Ambos subconjuntos de pacientes mostraron puntuaciones ESSDAI medias más altas y una estrecha asociación con la actividad sistémica que fue más pronunciada en los pacientes con hipocomplementemia C3. Este es un nuevo hallazgo, en contraste con estudios previos realizados en poblaciones geográficamente más homogéneas que mostraron un papel predominante en los niveles bajos de C4 para los peores resultados (linfoma y muerte). Probablemente, el diferente grado de asociación entre hipocomplementemia y crioglobulinemia (la crioglobulinemia se asocia más frecuentemente con el consumo de C4) podría explicar las diferencias con estudios previos, ya que la frecuencia de la crioglobulinemia está fuertemente influenciada por los determinantes geográficos y étnicos (3).
FENOTIPO DEL PACIENTE PORTADOR DE FACTOR REUMATOIDE
Los primeros estudios que incluyeron pequeñas series de pacientes con SSp describieron una asociación estadística independiente entre la positividad del FR y las principales características clínicas e inmunológicas de la enfermedad (11). Estudios recientes han demostrado el papel clave del FR que influye en el fenotipo del SSp, asociado a un diagnóstico temprano (10), predicción del desarrollo del SSp completo (41), pruebas oculares (42), disfunción severa de la gammagrafía parotídea (43), desarrollo de los centros germinales ectópicos (44), con la enfermedad sistémica o grave (24,45,46) y con el desarrollo de linfoma (26,47). Además, los datos de la cohorte del Big Data mostraron que el FR estaba presente en casi la mitad de nuestros pacientes, y su fenotipo específico consistía en edades más jóvenes al momento del diagnóstico, mayor frecuencia de pruebas de diagnóstico anormales, puntuación ESSDAI media más alta y una puntuación más elevada en la actividad sistémica en los dominios glandular, articular, cutáneo y hematológico. A pesar de esta asociación cercana y evidente con un fenotipo de enfermedad más activo y severo, el FR ha sido excluido en los dos últimos conjuntos de criterios de clasificación de la enfermedad. Por lo tanto, la detección del FR en el SSp es clínicamente útil, especialmente para el diagnóstico de algunos subconjuntos de pacientes con SSp, como aquellos con manifestaciones sistémicas/graves o con crioglobulinas circulantes.
FENOTIPO DEL PACIENTE INMUNONEGATIVO
Un fenotipo seronegativo de la enfermedad se define sobre la base de la ausencia de autoanticuerpos positivos incluidos en los criterios de clasificación correspondientes. Por lo tanto, un fenotipo seronegativo sobre la base de los criterios europeos de 1993 se define como pacientes con autoanticuerpos negativos ANA, FR, Ro y La, incluso en ausencia de biopsia salival positiva. En los conjuntos de criterios recientes de los años 2002/2016, los pacientes seronegativos deben ser pacientes con biopsia positiva con anticuerpos Ro/La negativos (criterios 2002) (48) o con anti-Ro negativo (criterios 2016) (14). En comparación con los pacientes seropositivos, el fenotipo clínico de estos pacientes se caracteriza por tres hallazgos principales: i) no hay diferencias significativas en las frecuencias/resultados anormales de signos y síntomas de afectación glandular; ii) mayor frecuencia de fatiga y dolor; y iii) menor frecuencia de afectación sistémica (5,12,37,49-51). Quartuccio y cols. (12) publicaron un estudio que comparó 342 pacientes con biopsia positiva que tenían anticuerpos anti-Ro/La y 206 pacientes con biopsia positiva y seronegativos; estos pacientes seronegativos demostraron tener una edad más avanzada al momento del diagnóstico y una menor frecuencia de inflamación parotídea, púrpura, leucopenia, linfoma, hipergammaglobulinemia, ANA, FR, C3 y C4 bajos y de crioglobulinas. Recientemente hemos replicado este estudio en la cohorte del Big Data (2073 pacientes seronegativos versus 3172 pacientes seropositivos con biopsia positiva) y descubrimos que el fenotipo seronegativo se asoció con un diagnóstico de la enfermedad a edades más avanzadas, mayor frecuencia de pruebas de diagnóstico orales anormales y una menor frecuencia de ANA, hipocomplementemia, FR y de crioglobulinemia en comparación con los pacientes seropositivos (52). Este perfil inmunológico más leve, conlleva un menor riesgo de desarrollar linfoma y un menor nivel de expansión de células B (12).
Un determinante clave que siempre debe evaluarse en pacientes con SSp seronegativos es la coexistencia de síndromes somáticos funcionales como el síndrome de fatiga crónica (SFC) y la fibromialgia (FM). La frecuencia de la superposición de la FM en pacientes con SSp varía del 15 al 35% (5,53–56), y su presencia concomitante se ha asociado estadísticamente no solo con el fenotipo seronegativo (5,55), sino también con depresión (56, 57), fatiga (53,58,59), dolor generalizado (5,59) y con un riesgo 10 veces mayor de discapacidad laboral (60). Con respecto al SFC, un tercio de los pacientes con síntomas de sequedad cumplieron con los criterios de diagnóstico para el SSp, aunque todos tenían un fenotipo seronegativo (49). Los pacientes seronegativos presentan un fenotipo que se ajusta a un espectro de la enfermedad que tiende más hacia síndromes somáticos funcionales como el SFC y la fibromialgia.
CONCLUSIÓN
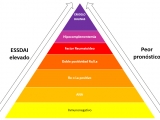
Después de revisar la literatura publicada en los últimos 20 años, incluidos datos muy recientes de grandes cohortes internacionales de pacientes, la cantidad y la calidad de la evidencia es suficiente para confirmar que los determinantes inmunológicos juegan un papel clave en la determinación del fenotipo del SSp (Figura 1). Un análisis general de los resultados publicados identifica una primera clasificación fenotípica de pacientes de acuerdo al grado de afectación glandular, tanto para la frecuencia de sequedad (síntomas subjetivos) como para la frecuencia de pruebas de diagnóstico glandulares anormales que revelan una función glandular anormal (pruebas objetivas). De este modo, algunos determinantes (etnia asiática, diagnóstico de inicio joven, hombres y portadores de anti-Ro) impulsan un fenotipo con una afectación glandular menos pronunciada, en contraste con otros asociados con una sequedad y disfunción glandular más pronunciada (seronegativos, portadores de La aislados). Además, los pacientes seronegativos presentan un fenotipo que también puede encajar en un espectro de enfermedades que tienden hacia síndromes somáticos funcionales como el SFC y la fibromialgia, debido a la mayor presencia de fatiga crónica y dolor. Los pacientes con una enfermedad fenotípica limitada a las superficies de la mucosa pueden requerir solo una evaluación anual, con un examen físico de rutina incluyendo la evaluación de las superficies mucosas para descartar complicaciones locales, pruebas de laboratorio que se deben realizar de forma rutinaria cada año, incluyendo recuento sanguíneo completo, parámetros metabólicos y renales y pruebas hepáticas, un papel clave de las especialidades involucradas en el cuidado de las principales superficies mucosas afectadas (oftalmología, odontología/medicina oral, ginecología) y coordinación de la atención médica de estos pacientes para los médicos de atención primaria. En contraste, los pacientes con determinantes que tienden a un fenotipo más sistémico/severo deben ser seguidos cada 3-6 meses, con un examen físico minucioso que incluya un examen de las glándulas salivales mayores, adenopatías periféricas y visceromegalias, y siguiendo un enfoque multidisciplinario que también incluya esas especialidades de los principales órganos internos involucrados (neumología, neurología, hematología, nefrología) bajo la coordinación de unidades altamente especializadas en enfermedades autoinmunes; estos pacientes deben ser evaluados al momento del diagnóstico (y durante el seguimiento) para detectar crioglobulinas, FR, factores del complemento C3/C4 e inmunoelectroforesis en suero, y deben evaluarse tanto para la actividad sistémica (ESSDAI) como para la vasculitis (cumplimiento de los criterios de la VC).
Bibliografía
1 Brito-Zerón P, Baldini C, Bootsma H, et al. Sjögren syndrome. Nat Rev Dis Prim 2016;2:16047.
2 Ramos-Casals M, Brito-Zerón P, Sisó-Almirall A, et al. Primary Sjogren syndrome. BMJ 2012;344:e3821.
3 Brito-Zeron P, Acar-Denizli N, Zeher M, et al. Influence of geolocation and ethnicity on the phenotypic expression of primary Sjögren’s syndrome at diagnosis in 8310 patients: a cross-sectional study from the Big Data Sjogren Project Consortium. Ann Rheum Dis 2017;76:1042–50.
4 Locht H, Pelck R, Manthorpe R. Clinical manifestations correlated to the prevalence of autoantibodies in a large (n=321) cohort of patients with primary Sjögren’s syndrome: a comparison of patients initially diagnosed according to the Copenhagen classification criteria with the America. Autoimmun Rev 2005;4:276–81.
5 ter Borg EJ, Kelder JC. Lower prevalence of extra-glandular manifestations and anti-SSB antibodies in patients with primary Sjögren’s syndrome and widespread pain: evidence for a relatively benign subset. Clin Exp Rheumatol 2014;32:349–53.
6 Venables PJ, Shattles W, Pease CT, et al. Anti-La (SS-B): a diagnostic criterion for Sjögren’s syndrome? Clin Exp Rheumatol 1989;7:181–4.
7 Baer AN, McAdams DeMarco M, Shiboski SC, et al. The SSB-positive/SSA-negative antibody profile is not associated with key phenotypic features of Sjögren’s syndrome. Ann Rheum Dis 2015;74:1557–61.
8 Brito-Zeron P, Acar-Denizli N, M Z, et al. Isolated Anti-La/SS-B Positivity in Patients Diagnosed with Primary Sjögren Syndrome: Analysis of 222 Patients from the Sjogren Big Data Cohort. Arthritis Rheumatol 2016;68:2683.
9 Retamozo S, Akasbi M, Brito-Zeron P, et al. Anti-Ro52 antibody testing influences the classification and clinical characterisation of primary Sjögren’s syndrome. Clin Exp Rheumatol 2012;30:686–92.
10 Theander E, Jonsson R, Sjöström B, et al. Prediction of Sjögren’s Syndrome Years Before Diagnosis and Identification of Patients With Early Onset and Severe Disease Course by Autoantibody Profiling. Arthritis Rheumatol (Hoboken, NJ) 2015;67:2427–36.
11 Ramos-Casals M, Brito-Zerón P, Perez-De-Lis M, et al. Sjögren syndrome or Sjögren disease? The histological and immunological bias caused by the 2002 criteria. Clin Rev Allergy Immunol 2010;38:178–85.
12 Quartuccio L, Baldini C, Bartoloni E, et al. Anti-SSA/SSB-negative Sjogren’s syndrome shows a lower prevalence of lymphoproliferative manifestations, and a lower risk of lymphoma evolution. Autoimmun Rev 2015;14:1019–22.
13 Ramos-Casals M, Brito-Zerón P, Solans R, et al. Systemic involvement in primary Sjögren’s syndrome evaluated by the EULAR-SS disease activity index: Analysis of 921 spanish patients (GEAS-SS registry). Rheumatol (United Kingdom) 2014;53:321–31.
14 Shiboski CH, Shiboski SC, Seror R, et al. 2016 American College of Rheumatology/European League Against Rheumatism classification criteria for primary Sjögren’s syndrome. Ann Rheum Dis 2017;76:9–16.
15 Danda D, Sharma R, Truong D, et al. Anti-La positive, anti-Ro negative subset of primary Sjogren’s syndrome: anti-La is a reality but is the disease? Clin Exp Rheumatol 2017;35:438–44.
16 Tzioufas AG, Hantoumi I, Polihronis M, et al. Autoantibodies to La/SSB in patients with primary Sjogren’s syndrome (pSS) are associated with upregulation of La/SSB mRNA in minor salivary gland biopsies (MSGs). J Autoimmun 1999;13:429–34.
17 Gourzi VC, Kapsogeorgou EK, Kyriakidis NC, et al. Study of microRNAs (miRNAs) that are predicted to target the autoantigens Ro/SSA and La/SSB in primary Sjögren’s Syndrome. Clin Exp Immunol 2015;182:14–22.
18 Yaciuk JC, Pan Y, Schwarz K, et al. Defective selection of thymic regulatory T cells accompanies autoimmunity and pulmonary infiltrates in Tcra-deficient mice double transgenic for human La/Sjogren’s syndrome-B and human La-specific TCR. J Immunol 2015;194:1514–22.
19 Pan Z-J, Horton CG, Lawrence C, et al. Plasmacytoid dendritic cells and type 1 interferon promote peripheral expansion of forkhead box protein 3(+) regulatory T cells specific for the ubiquitous RNA-binding nuclear antigen La/Sjogren’s syndrome (SS)-B. Clin Exp Immunol 2016;186:18–29.
20 Mahony R, Broadbent L, Maier-Moore JS, et al. The RNA binding protein La/SS-B promotes RIG-I-mediated type I and type III IFN responses following Sendai viral infection. Sci Rep 2017;7:14537.
21 Ramos-Casals M, Cervera R, Yagüe J, et al. Cryoglobulinemia in primary Sjögren’s syndrome: prevalence and clinical characteristics in a series of 115 patients. Semin Arthritis Rheum 1998;28:200–5.
22 Brito-Zeron P, Ramos-Casals M, Bove A, et al. Predicting adverse outcomes in primary Sjogren’s syndrome: identification of prognostic factors. Rheumatology 2007;46:1359–62.
23 Retamozo S, Gheitasi H, Quartuccio L, et al. Cryoglobulinaemic vasculitis at diagnosis predicts mortality in primary Sjögren syndrome: Analysis of 515 patients. Rheumatol (United Kingdom) 2016;55:1443–51.
24 Quartuccio L, Isola M, Baldini C, et al. Clinical and biological differences between cryoglobulinaemic and hypergammaglobulinaemic purpura in primary Sjogren’s syndrome: results of a large multicentre study. Scand J Rheumatol 2015;44:36–41.
25 Quartuccio L, Baldini C, Priori R, et al. Cryoglobulinemia in Sjogren Syndrome: A Disease Subset that Links Higher Systemic Disease Activity, Autoimmunity, and Local B Cell Proliferation in Mucosa-associated Lymphoid Tissue. J Rheumatol 2017;44:1179–83.
26 Nocturne G, Virone A, Ng W-F, et al. Rheumatoid Factor and Disease Activity Are Independent Predictors of Lymphoma in Primary Sjogren’s Syndrome. Arthritis Rheumatol 2016;68:977–85.
27 Baimpa E, Dahabreh IJ, Voulgarelis M, et al. Hematologic manifestations and predictors of lymphoma development in primary Sjögren syndrome: clinical and pathophysiologic aspects. Medicine (Baltimore) 2009;88:284–93.
28 Ramos-Casals M, Brito-Zerón P, Yagüe J, et al. Hypocomplementaemia as an immunological marker of morbidity and mortality in patients with primary Sjogren’s syndrome. Rheumatology (Oxford) 2005;44:89–94.
29 Shiboski CH, Baer AN, Shiboski SC, et al. Natural History and Predictors of Progression to Sjogren’s Syndrome Among Participants of the Sjogren’s International Collaborative Clinical Alliance Registry. Arthritis Care Res (Hoboken) 2018;70:284–94.
30 Theander E, Manthorpe R, Jacobsson LTH. Mortality and causes of death in primary Sjogren’s syndrome: a prospective cohort study. Arthritis Rheum 2004;50:1262–9.
31 Theander E, Henriksson G, Ljungberg O, et al. Lymphoma and other malignancies in primary Sjogren’s syndrome: a cohort study on cancer incidence and lymphoma predictors. Ann Rheum Dis 2006;65:796–803.
32 Fragkioudaki S, Mavragani CP, Moutsopoulos HM. Predicting the risk for lymphoma development in Sjogren syndrome: An easy tool for clinical use. Medicine (Baltimore) 2016;95:e3766.
33 Risselada AP, Kruize AA, Bijlsma JWJ. Clinical features distinguishing lymphoma development in primary Sjogren’s Syndrome--a retrospective cohort study. Semin Arthritis Rheum 2013;43:171–7.
34 Baldini C, Pepe P, Luciano N, et al. A clinical prediction rule for lymphoma development in primary Sjogren’s syndrome. J Rheumatol 2012;39:804–8.
35 Solans-Laque R, Lopez-Hernandez A, Bosch-Gil JA, et al. Risk, predictors, and clinical characteristics of lymphoma development in primary Sjogren’s syndrome. Semin Arthritis Rheum 2011;41:415–23.
36 Kimman J, Bossuyt X, Blockmans D. Prognostic value of cryoglobulins, protein electrophoresis, and serum immunoglobulins for lymphoma development in patients with Sjogren’s syndrome. A retrospective cohort study. Acta Clin Belg 2017;:1–13.
37 Quartuccio L, Isola M, Baldini C, et al. Biomarkers of lymphoma in Sjogren’s syndrome and evaluation of the lymphoma risk in prelymphomatous conditions: results of a multicenter study. J Autoimmun 2014;51:75–80.
38 Ioannidis JPA, Vassiliou VA, Moutsopoulos HM. Long-term risk of mortality and lymphoproliferative disease and predictive classification of primary Sjogren’s syndrome. Arthritis Rheum 2002;46:741–7.
39 Brito-Zeron P, Kostov B, Solans R, et al. Systemic activity and mortality in primary Sjogren syndrome: predicting survival using the EULAR-SS Disease Activity Index (ESSDAI) in 1045 patients. Ann Rheum Dis 2016;75:348–55.
40 Singh AG, Singh S, Matteson EL. Rate, risk factors and causes of mortality in patients with Sjogren’s syndrome: a systematic review and meta-analysis of cohort studies. Rheumatology (Oxford) 2016;55:450–60.
41 Liew MS Kim E, Akpek EK ZM, Liew MSH, Zhang M, et al. Prevalence and predictors of Sjogren’s syndrome in a prospective cohort of patients with aqueous-deficient dry eye. Br J Ophthalmol 2012;96:1498.
42 Lim SA, Nam S, Kwok S-K, et al. Serologic Markers Are Associated With Ocular Staining Score in Primary Sjogren Syndrome. Cornea 2015;34:1466–70.
43 Ramos-Casals M, Brito-Zeron P, Perez-De-Lis M, et al. Clinical and Prognostic Significance of Parotid Scintigraphy in 405 Patients with Primary Sjogren’s Syndrome. J Rheumatol 2010;37:585–90.
44 Risselada AP, Looije MF, Kruize A a., et al. The Role of Ectopic Germinal Centers in the Immunopathology of Primary Sjogren’s Syndrome: A Systematic Review. Semin Arthritis Rheum 2013;42:368–76.
45 Martel C, Gondran G, Launay D, et al. Active immunological profile is associated with systemic Sjogren’s syndrome. J Clin Immunol 2011;31:840–7.
46 Baldini C, Pepe P, Quartuccio L, et al. Primary Sjogren’s syndrome as a multi-organ disease: impact of the serological profile on the clinical presentation of the disease in a large cohort of Italian patients. Rheumatology (Oxford) 2014;53:839–44.
47 Tzioufas AG, Boumba DS, Skopouli FN, et al. Mixed monoclonal cryoglobulinemia and monoclonal rheumatoid factor cross-reactive idiotypes as predictive factors for the development of lymphoma in primary Sjogren’s syndrome. Arthritis Rheum 1996;39:767–72.
48 Vitali C, Bombardieri S, Jonsson R, et al. Classification criteria for Sjögren’s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis 2002;61:554–8.
49 Nishikai M, Akiya K, Tojo T, et al. ‘Seronegative’ Sjogren’s syndrome manifested as a subset of chronic fatigue syndrome. Br J Rheumatol 1996;35:471–4.
50 Price EJ, Venables PJW. Dry eyes and mouth syndrome--a subgroup of patients presenting with sicca symptoms. Rheumatology (Oxford) 2002;41:416–22.
51 Segal BM, Pogatchnik B, Henn L, et al. Pain severity and neuropathic pain symptoms in primary Sjogren’s syndrome: a comparison study of seropositive and seronegative Sjogren’s syndrome patients. Arthritis Care Res (Hoboken) 2013;65:1291–8.
52 Brito-Zeron P, Acar-Denizli N, Zeher M, et al. How Does Primary Sjögren Syndrome Present in Biopsy-Proven Patients without Circulating Ro/La Autoantibodies? Characteristics at Diagnosis of 2073 Patients from the Sjögren Big Data Project. Arthritis Rheumatol 2016;68:2682.
53 Torrente-Segarra V, Corominas H, Sanchez-Piedra C, et al. Fibromyalgia prevalence and associated factors in primary Sjögren’s syndrome patients in a large cohort from the Spanish Society of Rheumatology registry (SJOGRENSER). Clin Exp Rheumatol 2017;35 Suppl 1:28–34.
54 Priori R, Iannuccelli C, Alessandri C, et al. Fatigue in Sjögren’s syndrome: relationship with fibromyalgia, clinical and biologic features. Clin Exp Rheumatol 2010;28:S82-6.
55 Ostuni P, Botsios C, Sfriso P, et al. Fibromyalgia in Italian patients with primary Sjögren’s syndrome. Joint Bone Spine 2002;69:51–7.
56 Choi BY, Oh HJ, Lee YJ, et al. Prevalence and clinical impact of fibromyalgia in patients with primary Sjogren’s syndrome. Clin Exp Rheumatol 2016;34:S9-13.
57 Vitali C, Tavoni A, Neri R, et al. Fibromyalgia features in patients with primary Sjögren’s syndrome. Evidence of a relationship with psychological depression. Scand J Rheumatol 1989;18:21–7.
58 Karageorgas T, Fragioudaki S, Nezos A, et al. Fatigue in Primary Sjögren’s Syndrome: Clinical, Laboratory, Psychometric, and Biologic Associations. Arthritis Care Res (Hoboken) 2016;68:123–31.
59 Iannuccelli C, Spinelli FR, Guzzo MP, et al. Fatigue and widespread pain in systemic lupus erythematosus and Sjögren’s syndrome: symptoms of the inflammatory disease or associated fibromyalgia? Clin Exp Rheumatol 2012;30:117–21.
60 Mandl T, Jorgensen TS, Skougaard M, et al. Work Disability in Newly Diagnosed Patients with Primary Sjögren Syndrome. J Rheumatol 2017;44:209–15.