Volumen 38, Nº 1 | 2020
Microbiota y Enfemedades Inflamatorias Intestinales - Microbiota and its impact on Inflammatory Bowel Diseases
José Ignacio Revigliono, Pablo A Romagnoli
Palabras clave: Microbiota, Disbiosis, Enfermedades Inflamatorias Intestinales, Medicina de Precisión
Keywords: Microbiota, Dysbiosis, Inflammatory Bowel Diseases, Precision Medicine
Un poco de historia. La microbiota se define como el conjunto de microorganismos que vive en un ambiente específico como por ejemplo el de cada tejido de nuestro organismo. Las primeras descripciones de la microbiota asociada a los humanos se remontan al siglo XVII, cuando Antonie van Leeuwenhoek comenzó a usar sus microscopios artesanales (1). En su carta a la Royal Society de Londres, describió e ilustró cinco tipos diferentes de bacterias presentes en la cavidad oral. Posteriormente comparó su propia microbiota oral y fecal, determinando que existen diferencias entre los microorganismos presentes en distintos sitios del cuerpo, así como también entre momentos de salud y enfermedad. Dos siglos después, Louis Pasteur desarrolló la teoría de los gérmenes de la enfermedad, pensando también que los microorganismos no patógenos podrían tener un papel importante en la fisiología humana normal (2). Por otro lado, Iliá Metchnikoff creía que la composición de la microbiota y sus interacciones con el anfitrión eran esenciales para la salud (3) mientras que Theodor Escherich estaba convencido de que comprender la flora endógena era esencial para comprender la fisiología de la digestión, la patología y la terapia de la enfermedad intestinal (4). Luego de casi 350 años de hallazgos aislados, la comunidad científica ha vuelto a poner el foco en investigar los efectos de la microbiota (5).
La microbiota y su composición. Nuestras vidas están profundamente relacionadas con un mundo dominado por microbios. Los microbios impulsan muchos ciclos geoquímicos globales que, en última instancia, nos proporcionan oxígeno, alimento y agua. En un nivel más fisiológico diversas comunidades microbianas se reúnen y persisten en las superficies externas e internas de nuestros cuerpos desde el momento de nuestro nacimiento hasta nuestra muerte. Nuestro tracto gastrointestinal es el hogar para una gran cantidad de microorganismos. Estos microbios superan en número a nuestras propias células humanas en un orden de magnitud (6). Esta percepción de nosotros mismos ha dado lugar a la idea de que en realidad somos "supraorganismos" cuya contenido genético resulta de la suma de genes en nuestro genoma de homo sapiens y el de "nuestros" socios microbianos que conforman la microbiota, obteniendo entonces sus características metabólicas gracias a la suma de los atributos humanos y microbianos (7). En particular, la microbiota que habita nuestros intestinos es una comunidad diversa y activa de microorganismos, con un peso aproximado de 200 gr en seco y con más de 1000 especies diferentes de virus, hongos y bacterias, en su mayoría del tipo anaerobio. El 90% de las bacterias se encuentran en el colon. En su mayoría son de las familias Bacteroidetes (genus Bacteroides y Prevotella), de la familia Firmicutes (genus Lactobacillus y Clostridium), y en menor medida de la familia de Actinobacterias (genus Bifidobacterium). Estos microorganismos generan una simbiosis de “mutualismo” con el ser humano, logrando una relación beneficiosa para ambos (8).
La microbiota y su desarrollo. El desarrollo de la microbiota intestinal en la infancia, ocurre durante una ventana crítica y es de gran importancia debido al impacto en la salud en la vida del ser humano ya que una alteración en este proceso puede resultar en múltiples enfermedades inmunes en la etapa adulta (9). Aunque la colonización bacteriana intestinal comienza cuando el feto se encuentra en la parte inferior del útero, la microbiota intestinal de un bebé se establece después del nacimiento. La conformación de una microbiota intestinal estable generalmente conlleva dos grandes transiciones en la infancia. La primera transición ocurre poco después del nacimiento, durante la lactancia, y resulta en el predominio de la microbiota intestinal por la familia de las Bifidobacterium (9). La segunda transición ocurre durante el período de destete, con la introducción de alimentos sólidos y la continuación de la alimentación con leche materna, y da como resultado el establecimiento de un microbioma complejo de tipo adulto dominado por las familias de Bacteroidetes y Firmicutes (10). Estas alteraciones continúan hasta los tres años de edad, posteriormente, los humanos adquieren una microbiota intestinal estable que se mantiene en estados simbióticos bien equilibrados denominados "Enterotipos" compuestos por Bacteroides, Prevotella o Firmicutes (11).
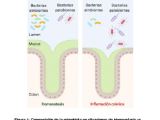
Alteraciones de la microbiota. La industrialización ha llevado a la salud humana a una serie de avances a través del saneamiento, los antibióticos, la vacunación, la producción de alimentos y la tecnología médica. En consecuencia, se ha observado una reducción dramática de todas las enfermedades infecciosas, lo que resulta en una reducción de la mortalidad infantil y una vida útil prolongada como claros beneficios para la sociedad en general (12). Sin embargo, coincidente con estas mejoras, se ha producido una desregulación del sistema inmune de etiología poco clara que se puede ver en el aumento global de las enfermedades no transmisibles como obesidad, diabetes, enfermedades cardíacas, etc. La fuente de la desregulación inmune en las sociedades industrializadas sigue sin estar clara, y las alteraciones en la microbiota pueden ser tanto el resultado de la desregulación inmune como su contribución a ella (13). Esta alteración en la composición homeostática normal de la microbiota se denomina Disbiosis (Figura 1), proceso caracterizado por una disminución de la composición de bacterias simbiontes y un aumento de la composición de bacterias patobiontes. Esta situación suele estar íntimamente relacionada a múltiples patologías como la Enfermedad Inflamatoria Intestinal (EII), autismo, cáncer, alergias y enfermedades metabólicas como diabetes, enfermedad cardiovascular y obesidad. La disbiosis intestinal puede estar causada por predisposición genética, alteraciones inmunológicas del huésped y fenómenos epigenéticos; esto genera desequilibrios en la fisiología, inmunidad y susceptibilidad a enfermedades (14). Por ello, estudiar la microbiota puede darnos información valiosa acerca de cómo está el sistema inmune de la mucosa intestinal.
La microbiota y la mucosa intestinal. La microbiota influencia el desarrollo de todo el sistema inmune a través de interacciones con la mucosa intestinal (15). Esta interacción no sólo define las respuestas inmunes a nivel local (16) sino también la de tejidos distantes como los del sistema nervioso, con evidencia emergente de que la microbiota intestinal influye en la química del cerebro, su desarrollo y comportamiento (17). El sistema inmune de la mucosa intestinal responde a la microbiota de manera de contener la inflamación en el tracto gastrointestinal mediante la inducción de células T regulatorias mediada por células dendríticas y macrófagos (18) o la generación de anticuerpos mediante células plasmáticas (19). En general, la respuesta inmune humoral en mucosa a la microbiota siempre se ha asociado a la presencia de inmunoglobulina (Ig) A (20). Sin embargo, actualmente existe una creciente evidencia del rol de la Inmunoglobulina (Ig) G protegiendo a la mucosa intestinal de invasión bacteriana (21) y seria muy interesante investigar su rol en la patogenia de las EII.
La microbiota y la EII. La EII comprende distintas entidades patológicas, entre ellas la Enfermedad de Crohn (EC) (22) y la Colitis Ulcerosa (CU) (23). Diversos factores participan de la patogénesis de la EII, pero se especula de que esta enfermedad ocurre debido a una respuesta desregulada del sistema inmune a la microbiota presente en la mucosa intestinal en individuos genéticamente predispuestos (24). Este rango diverso de condiciones inflamatorias propias de la mucosa intestinal son el resultado de múltiples factores, entre ellos la composición de la microbiota sumada al perfil genético de los pacientes con EII (25). Esta predisposición genética presente en el genoma está siendo cada vez mejor definida, incluyendo ya más de 240 locus con genes que incrementan el riesgo de desarrollar EII (26). Sin embargo, todavía no se conoce el agente etiológico que promueve la inflamación de la mucosa intestinal. Una posibilidad de estudio clave en nuestro medio por ejemplo seria conocer cuál es la composición de la microbiota que esta promoviendo la inflamación intestinal en pacientes con EII usando la IgG como biomarcador de patogenicidad. Esto proporcionaría además biomarcadores para el seguimiento de la EII, tanto de su progresión como su resolución.
La microbiota en la medicina de precisión. El estudio de la microbiota ofrece entonces un gran oportunidad para modular del sistema inmune, pudiendo mitigar no solo condiciones como la EII sino también otras enfermedades inflamatorias ya que es un contribuyente maleable y potente del status inmune. Se visualiza un futuro en el que se pueda crear un arsenal de herramientas microbianas, basadas en la dieta y derivados de la microbiota para dilucidar las respuestas inmunes específicas, sus trayectorias y alteraciones para lograr el punto de ajuste inmune (27). Esto probablemente incluya el monitoreo de la colonización de la microbiota con determinadas familias de bacterias y el estado inmune durante los períodos críticos de desarrollo en la infancia y la primera infancia con enfoques de precisión como la metagenómica para guiar la terapia. El microbioma puede convertirse entonces en una herramienta poderosa de la medicina de precisión, adaptando las terapias a la composición del microbioma y las circunstancias individualizadas para cada paciente como por ejemplo conocer el contenido de la microbiota de pacientes con EII para predecir su respuesta al tratamiento con biológicos (28) . El monitoreo tanto de la microbiota como del sistema inmune, será un paso clave para impulsar la precisión y las intervenciones personalizadas en las enfermedades inflamatorias de la mucosa intestinal como la EII o sistémicas como la alergia y autoinmunidad.
CONFLICTOS DE INTERÉS:
No existen conflictos de interés
Bibliografía
1. Van Leeuwenhoek A. Observations, communicated to the publisher by Mr. Antony van Leewenhoeck, in a dutch letter of the 9th Octob. 1676. here English'd: concerning little animals by him observed in rain-well-sea- and snow water; as also in water wherein pepper had lain infused. Philosophical Transactions. 1677;12(133):821-31.
2. Pasteur L. JC, Chamberland C. La theorie des germes et ses applications a la medicine et a la chirurgie. C R Acad Sci Hebd Seances Acad Sci. 1878;86:1037–43.
3. Metchnikoff E. The Prolongation of Life: Optimistic Studies, Revised Edition of 1907: Heinemann, London; 1910.
4. Escherich, T. Die Darmbakterien des Neugeborenen und Sauglings. Fortschr Med. 1885;3:515-22, 47-447.
5. Belkaid Y, Naik S. Compartmentalized and systemic control of tissue immunity by commensals. Nature immunology. 2013;14(7):646-53.
6. Group NHW, Peterson J, Garges S, Giovanni M, McInnes P, Wang L, et al. The NIH Human Microbiome Project. Genome Res. 2009;19(12):2317-23.
7. Ahmed S, Macfarlane GT, Fite A, McBain AJ, Gilbert P, Macfarlane S. Mucosa-associated bacterial diversity in relation to human terminal ileum and colonic biopsy samples. Appl Environ Microbiol. 2007;73(22):7435-42.
8. Peterson DA, Frank DN, Pace NR, Gordon JI. Metagenomic approaches for defining the pathogenesis of inflammatory bowel diseases. Cell host & microbe. 2008;3(6):417-27.
9. Ramakrishna BS. Role of the gut microbiota in human nutrition and metabolism. J Gastroenterol Hepatol. 2013;28 Suppl 4:9-17.
10. Palmer C, Bik EM, DiGiulio DB, Relman DA, Brown PO. Development of the human infant intestinal microbiota. PLoS Biol. 2007;5(7):e177.
11. Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR, et al. Enterotypes of the human gut microbiome. Nature. 2011;473(7346):174-80.
12. Bach JF. The effect of infections on susceptibility to autoimmune and allergic diseases. N Engl J Med. 2002;347(12):911-20.
13. Sonnenburg JL, Sonnenburg ED. Vulnerability of the industrialized microbiota. Science (New York, NY. 2019;366(6464).
14. Kamada N, Seo SU, Chen GY, Nunez G. Role of the gut microbiota in immunity and inflammatory disease. Nature reviews. 2013;13(5):321-35.
15. Kaser A, Zeissig S, Blumberg RS. Inflammatory bowel disease. Annual review of immunology. 2010;28:573-621.
16. Ivanov, II, Atarashi K, Manel N, Brodie EL, Shima T, Karaoz U, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 2009;139(3):485-98.
17. Rothhammer V, Mascanfroni ID, Bunse L, Takenaka MC, Kenison JE, Mayo L, et al. Type I interferons and microbial metabolites of tryptophan modulate astrocyte activity and central nervous system inflammation via the aryl hydrocarbon receptor. Nature medicine. 2016.
18. Mowat AM, Agace WW. Regional specialization within the intestinal immune system. Nature reviews. 2014;14(10):667-85.
19. Kubinak JL, Round JL. Do antibodies select a healthy microbiota? Nature reviews. 2016;16(12):767-74.
20. Macpherson AJ, McCoy KD, Johansen FE, Brandtzaeg P. The immune geography of IgA induction and function. Mucosal immunology. 2008;1(1):11-22.
21. Zeng MY, Cisalpino D, Varadarajan S, Hellman J, Warren HS, Cascalho M, et al. Gut Microbiota-Induced Immunoglobulin G Controls Systemic Infection by Symbiotic Bacteria and Pathogens. Immunity. 2016;44(3):647-58.
22. Torres J, Mehandru S, Colombel JF, Peyrin-Biroulet L. Crohn's disease. Lancet. 2017;389(10080):1741-55.
23. Ungaro R, Mehandru S, Allen PB, Peyrin-Biroulet L, Colombel JF. Ulcerative colitis. Lancet. 2017;389(10080):1756-70.
24. Ananthakrishnan AN. Epidemiology and risk factors for IBD. Nature reviews Gastroenterology & hepatology. 2015;12(4):205-17.
25. DeFilippis EM, Longman R, Harbus M, Dannenberg K, Scherl EJ. Crohn's Disease: Evolution, Epigenetics, and the Emerging Role of Microbiome-Targeted Therapies. Current gastroenterology reports. 2016;18(3):13.
26. Huang H, Fang M, Jostins L, Umicevic Mirkov M, Boucher G, Anderson CA, et al. Fine-mapping inflammatory bowel disease loci to single-variant resolution. Nature. 2017;547(7662):173-8.
27. Spencer SP, Fragiadakis GK, Sonnenburg JL. Pursuing Human-Relevant Gut Microbiota-Immune Interactions. Immunity. 2019;51(2):225-39.
28. Ananthakrishnan AN, Luo C, Yajnik V, Khalili H, Garber JJ, Stevens BW, et al. Gut Microbiome Function Predicts Response to Anti-integrin Biologic Therapy in Inflammatory Bowel Diseases. Cell host & microbe. 2017;21(5):603-10 e3.