Volumen 38, Nº 1 | 2020
Manejo del espacio residual pleural post resección pulmonar - Management of residual pleural space after lung resection
Ignacio Sastre, Manuel España, Roberto Ceballos, Mario EF. Bustos
Palabras clave: resección pulmonar; pleurodesis; cavidad pleural, espacio pleural residual
Keywords: lung resection; pleurodesis; pleural cavity, residual pleural space
INTRODUCCIÓN
El espacio pleural residual post resección pulmonar asociado a fuga aérea es un hallazgo frecuente. Se informa que puede ocurrir hasta en el 40% de los pacientes en los primeros días postoperatorios, según la extensión de la resección, la compliancia del pulmón remanente, la caja torácica y la enfermedad subyacente (1). Si bien en tiempos pasados representaba un mal pronóstico para el paciente, actualmente se sabe que corresponde a una condición benigna que tiende a una completa resolución o a la presencia de un espacio pleural persistente sin implicaciones clínicas (1-3). Por lo general, el espacio se llena con líquido estéril en primera instancia, y luego algunas modificaciones en la fisiología del tórax como la hiperinsuflación del pulmón restante, el desplazamiento del mediastino, la elevación del hemidiafragma y el estrechamiento de los espacios intercostales, contribuyen a la eliminación del espacio residual (1).
Cuando la cámara residual es grande y/o se asocia a fuga aérea persistente, el cirujano torácico se encuentra bajo una situación desafiante, ya que la misma tiende a prolongar la permanencia de los drenajes, y consecuentemente la estadía hospitalaria, los costos de salud y la morbilidad del paciente, como así también aparece la percepción subjetiva de falla en la intervención quirúrgica (2). Entre los factores que contribuyen a esta complicación se encuentran: un drenaje pleural insuficiente, enfermedad pulmonar restrictiva subyacente, bi-lobectomías, fuga de aire persistente y fijación del mediastino (3).
Con el avance en el conocimiento de esta complicación, el tratamiento y enfoque actual del espacio pleural residual post resección tiende a ser más conservador, evitando las re-intervenciones mayores, como se hacía en décadas pasadas. Para ello existen varias técnicas que favorecen la ocupación pleural y el cese de la fuga aérea.
Presentamos 2 casos, a los que se les realizó conjuntamente bloqueo del nervio frénico a nivel cervical, neumoperitoneo y pleurodesis química de forma exitosa.
CASO CLÍNICO 1
Varón de 65 años de edad, longilíneo, ex tabaquista, al que se le realiza lobectomía superior derecha por videotoracoscopía con resección en manguito de la vía aérea por carcinoma epidermoide endobronquial (TIb N0 M0, de la 8va Edición del sistema de estadificación TNM) localizado en bronquio del lóbulo superior derecho.
El paciente evoluciona favorablemente en los primeros días postoperatorios, por lo que se indica alta hospitalaria al quinto día, luego de 48 horas sin fuga aérea y con expansión completa del pulmón operado, comprobado radiológicamente.
Retorna a control al séptimo día refiriendo malestar general. Se constata fibrilación auricular (FA) de alta respuesta y neumotórax asociado del hemitórax operado. Se coloca nuevamente drenaje torácico. Se logra expansión parcial con el drenaje torácico.
Dado que el paciente presentaba buen estado general, se realizó neumoperitoneo terapéutico, y luego de la incorporación 1500 cc de aire, se realizó bloqueo del nervio frénico a nivel cervical.
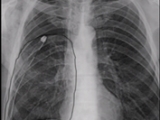
Al constatarse la elevación del diafragma se realizó pleurodesis química con doxiciclina a través del drenaje pleural. El resultado fue el cese de la fuga aérea y la obliteración completa del espacio pleural residual (Figura 1).
CASO CLÍNICO 2
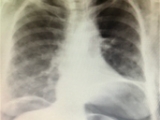
Paciente femenina de 65 años, ex tabaquista severa, con Enfermedad Pulmonar Obstructiva Crónica (EPOC) e hipertensión arterial, a la que se le realiza lobectomía superior izquierda por videotoracoscopía, con diagnóstico histopatológico de adenocarcinoma pulmonar predominantemente lipídico (T1b N0 M0, 8va Edición del sistema de estadificación TNM). A las 24 horas del postoperatorio se evidencia falta de expansión pulmonar importante, manifestado a través de espacio residual radiológico y fuga aérea en el drenaje. Al persistir, al quinto día postoperatorio se realiza videotoracoscopía exploradora, reforzando la sutura parenquimatosa pulmonar y corroborando la indemnidad del bronquio. A las 48 horas de este procedimiento presenta fuga aérea escasa y mejora de la expansión del parénquima por radiografía; se coloca una válvula de Heimlich y se otorga el alta hospitalaria. La paciente regresa antes de las 24 horas del alta con enfisema subcutáneo extendido hasta la cara y el abdomen. Se reconecta la campana de drenaje, previa extracción de la válvula de Heimlich.
Se decide entonces realizar bloqueo cervical de nervio frénico, neumoperitoneo terapéutico y pleurodesis química por drenaje. Al cuarto día se retira drenaje y se otorga el alta hospitalaria (Figura 2).
TÉCNICA UTILIZADA
Bloqueo cervical del nervio frénico
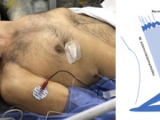
Cada paciente se posicionó en decúbito dorsal, con la cabeza hacia el lado contralateral al hemitórax afectado. Se realizó asepsia y antisepsia de la región cervical. Se tomó como reparo la clavícula y el músculo esternocleidomastoideo. Se identificó con ultrasonido utilizando sonda lineal MHz el trayecto superficial del nervio, entre el músculo esternocleidomastoideo y el músculo escaleno anterior. Se confirmó con la aplicación de neuroestimulación, observando la contracción diafragmática. Se instiló 10 ml de bupivacaína al 0,25% (Figura 3).
Neumoperitoneo y pleurodesis por tubo de drenaje
Posteriormente, se pasó al paciente a sala de quirófano. Se posicionó en decúbito dorsal. Bajo sedación y anestesia raquídea, se realizó asepsia y antisepsia de tórax y abdomen. Se colocó campos quirúrgicos. Primero se abordó el abdomen: incisión supraumbilical en línea media de 1,5 cm, se disecó por planos e ingresó a cavidad abdominal. Se colocó sonda trasparente estéril intrabadominal. Se fijó con vicryl y se cerró con una llave de tres vías (Figura 4A) Se instiló 1500 ml de aire en el inicio, y luego 500 ml por día a través de un dispositivo armado por los autores (Figura 4B).
Luego se realizó pleurodesis con doxiciclina por tubo de drenaje pleural. Se clampeó este último por 1 hora.
DISCUSIÓN
La presencia de espacio residual pleural postoperatorio postresección pulmonar se reporta en el 20% de los pacientes sometidos a lobectomía, en el 40% en bi-lobectomías o lobectomías y resección en cuña, y en un 5-10% en quienes se someten a segmentectomía o solo resección en cuña (3). Se han descritos colgajos musculares, de omento, hasta incluso toracoplastia para su tratamiento (1,3). Pero al ser los porcentajes de incidencia de esta complicación no despreciables, y las técnicas nombradas un tanto complejas y que muchas veces aportan más morbilidad que la propia complicación a tratar, llevan al cirujano a analizar y buscar estrategias quirúrgicas más conservadoras para resolver este cuadro. Lackey y Mitchell han concluido en una revisión que, además, se trata de una complicación que retrasa el alta del paciente y afecta la calidad de la atención prestada, lo que lleva a intentar ser lo más efectivo y lo menos agresivo posible para el tratamiento (2).
En primera instancia existen maniobras intraoperatorias para evitar esta complicación como la tienda pleural, la fricción o bloqueo con anestésico local del nervio frénico torácico y la sección del ligamento pulmonar. Luego, ya en el post-operatorio, el primer escalón siempre consiste en la permanencia del drenaje torácico y la aplicación de aspiración continua controlada, junto con la ayuda de la kinesioterapia respiratoria y la movilización activa temprana (4). No siempre con resultado exitoso la tendencia que se sigue hoy es, en casos seleccionados, otorgar el alta con drenaje utilizando la válvula de Heimlich y control ambulatorio, aunque también pueden complicarse (4). La aplicación de técnicas que logren solucionar la fuga y el espacio residual previo al alta, es mejor y más satisfactorio, ya que también se evitan otras complicaciones como las infecciones (1-3).
Aplicamos en los dos casos descriptos el bloqueo cervical del nervio frénico, acompañado de neumoperitoneo y posteriormente pleurodesis química.
El bloqueo del nervio frénico ipsilateral surge como opción terapéutica, luego de describirse como efecto indeseable del bloqueo del plexo braquial en anestesia en cirugía de miembro superior, con el consecuente ascenso del diafragma. El procedimiento se realiza bajo guía ecográfica identificando el trayecto cervical del mismo, entre los músculos escalenos, superficialmente. Con la ayuda de un neuroestimulador, se localiza el nervio; posteriormente se instila anestésico local, como bupivacaína al 0,25 o 0,5%. El efecto dura horas y se resuelve completamente (5). La ventaja radica en ser mínimamente invasiva, controlable, reversible, reproducible y segura (1).
En cuanto al neumoperitoneo se puede realizar de diversas maneras. Algunos lo realizan por vía torácica durante la cirugía resectiva, a través de una pequeña apertura diafragmática, de forma preventiva (6); otros, para tratar la complicación utilizan una incisión periumbilical e intruducen aire a través de una aguja de Veress (7). Nosotros preferimos hacerlo a través de un abordaje mini-invasivo supra umbilical por la línea media, dejando un catéter fijado e introduciendo 1000 - 1500 ml al inicio o más, y luego 500 ml de aire por día si es necesario, controlando al paciente de forma clínica y radiológica.
Cerfolio y cols, demostraron en un trabajo comparativo entre 2 grupos, uno con y otro sin neumoperitoneo trans-diafragmático profiláctico intra-quirúrgico, el cese completo de fuga y ocupación pleural completa al tercer día post-operatorio de todos los pacientes del primer grupo (6). De Giacomo y cols lograron obliteración del espacio residual pleural con una media de 4 días en 10 pacientes complicados posterior a una resección mayor (7). Esto nos demuestra el beneficio del neumoperitoneo, no encontrando efectos adversos significativos. El tiempo que tarda en absorberse el aire intra-abdominal, normalmente ronda los 7 a 14 días (4,6).
Aprovechando la reducción de la cavidad pleural y el contacto entre ambas pleuras, visceral y parietal, luego de los procedimientos descriptos, se agrega como maniobra final la pleurodesis química con doxiciclina a través del drenaje, que favorece la sínfisis y el sellamiento de las fugas pleuro-parenquimatosas. Tanto los derivados de la tetraciclina, como el talco, la quinacrina y el nitrato de plata, a través del avenamiento pleural, han obtenido resultados exitosos en la generación de inflamación pleural (4). Se utiliza también hoy en día sangre autóloga, que también provoca reacción inflamatoria pleural, y tiene buenos resultados en el sellamiento de la misma (4,8).
Como conclusión, en base a nuestros casos, la utilización de estas técnicas parece ser seguro y efectiva en los pacientes que presentan gran espacio residual y fuga aérea persistente.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses relacionados a la confección del manuscrito.
Bibliografía
1. Patella M, Saporito A, Mongelli F, Pini R, Inderbitzi R, Cafarotti S. Management of residual pleural space after lung resection: fully controllable paralysis of the diaphragm through continuous phrenic nerve block. J Thorac Dis 2018; 10(8):4883-90.2. Lackey A, Mitchell JD. The cost of air leak: physicians’ and patients’ perspectives. Thorac Surg Clin 2010; 20:407-11.
3. Solak O, Sayar A, Metin M, Turna A, Erdogu V, Pekçolaklar A, et al. Definition of postresectional residual pleural space. Can J Surg. 2007; 50(1):39–42.
4. Venuta F, Rendina EA, De Giacomo T, Coloni GF. Postoperative Strategies to Treat Permanent Air Leaks. Thorac Surg Clin. 2010; 20(3):391–7.
5. Ip VHY, Tsui BCH. Continuous interscalene block: the good, the bad and the refined spread. Acta Anaesthesiol Scand 2012;56:526-30
6. Cerfolio RJ, Holman WL, Katholi CR. Pneumoperitoneum after concomitant resection of the right middle and lower lobes (bilobectomy). Ann Thorac Surg. 2000; 70(3):942–6
7. De Giacomo T, Rendina EA, Venuta F, Francioni F, Moretti M, Pugliese F, et al. Pneumoperitoneum for the management of pleural air space problems associated with major pulmonary resections. Ann Thorac Surg 2001;72:1716–9
8. Andreetti C, Venuta F, Anile M, De Giacomo T, Diso D, Di Stasio M, et al. Pleurodesis with an autologous blood patch to prevent persistent air leaks after lobectomy. J Thorac Cardiovasc Surg 2007;133:759–62.
Imágenes
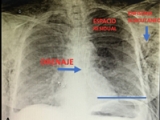
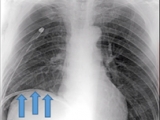
Figura 2. A: Drenaje pleural normoinserto, persistencia de espacio residual apical grande y enfisema subcutáneo
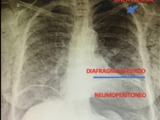
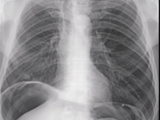
Figura 2 B: Radiografía post triple procedimiento, donde se observa elevación del hemidifragma izquierdo, disminución sustancial del espacio residual y neumoperitoneo terapéutico.