Volumen 2, Nº 36 | 2018
Trasplante alogénico de médula ósea en pacientes pediátricos con enfermedades no malignas. - Allogeneic bone marrow transplantation in pediatric patients with non-malignant diseases
Lorena Sartori, Juan José García, Adriana Berretta, Carlos Hollmann, Pablo García, María Virginia García
Palabras clave: trasplante alogénico de células madre hematopoyéticas, enfermedades no malignas, enfermedad injerto contra huésped, mortalidad.
Keywords: Allogeneic hematopoietic stem cell transplantation, nonmalignant disorders, graft vs host disease, mortality.
INTRODUCCIÓN
El trasplante alogénico de células madre hematopoyéticas (TMO) es una modalidad potencialmente curativa para una variedad de trastornos no malignos que involucran falla de la médula ósea. Se ha utilizado con éxito como terapia de reemplazo para pacientes con hemoglobinopatías, anemia de Fanconi (AF), enfermedades de inmunodeficiencia (ID) y trastornos metabólicos hereditarios (TMH), (1).
Las hemoglobinopatías son enfermedades hereditarias que requieren transfusiones de glóbulos rojos de por vida para tratar la anemia causada por la eritropoyesis intramedular ineficaz y el aumento de la destrucción de glóbulos rojos en la circulación periférica.
La AF es un trastorno autosómico recesivo que pertenece al grupo de síndrome de inestabilidad cromosómica, que se caracteriza clínicamente por malformaciones congénitas, hipersensibilidad a agentes alquilantes, falla progresiva de la médula ósea y predisposición a leucemia mieloide aguda. El TMO debe realizarse antes de que la enfermedad evolucione a síndrome mielodisplásico o a leucemia, y en aquellos pacientes que requieren demasiadas transfusiones de sangre (2).
Las ID son un grupo heterogéneo de más de 200 enfermedades congénitas causadas por defectos funcionales de los diferentes mecanismos involucrados en la respuesta inmune. Se caracterizan por una pobre respuesta a agentes infecciosos, lo que lleva a una infección recurrente y una mayor prevalencia de manifestaciones autoinmunes, alergias y trastornos linfoproliferativos. Alrededor del 60% de estas enfermedades se diagnostican durante infancia (4). En 1968 el primer trasplante de médula ósea entre hermanos con HLA idéntico se realizó con éxito en un niño con inmunodeficiencia combinada severa. Desde entonces, los trasplantes de otras fuentes y tipos de donantes se han utilizado con buenos resultados (4).
Los TMH son un grupo diverso de enfermedades derivadas de los defectos en las enzimas lisosomales o de la función peroxisomal. Las enzimas lisosómicas son hidrolíticas y se almacenan en orgánulos celulares llamados lisosomas. Los peroxisomas son orgánulos subcelulares implicados en el metabolismo de los lípidos. Estas enfermedades se caracterizan por devastadores procesos sistémicos que afectan la función neurológica y cognitiva, el crecimiento y desarrollo, y el estado cardiopulmonar. Al inicio en la infancia generalmente se acompañan de un deterioro rápido y se asocian con muerte prematura. Las recomendaciones de tratamiento se basan en su fenotipo, incluida la edad de inicio, la tasa de progresión, la gravedad de signos y síntomas clínicos, valores familiares y expectativas, y los riesgos y beneficios asociados con terapias disponibles tales como TMO (5).
El objetivo del TMO en la mayoría de las enfermedades no malignas es proporcionar un grado suficiente de injerto para permitir la mejoría a largo plazo de los síntomas resultantes de un trastorno adquirido. El grado de injerto requerido difiere dependiendo de la enfermedad en cuestión, y en ciertas condiciones, incluso un injerto completo puede no conducir a la corrección completa del fenotipo (6).
La cuidadosa selección de las condiciones pre-trasplante y el acondicionamiento pueden reducir significativamente las complicaciones relacionadas con la mortalidad temprana post trasplante, aumentar la probabilidad de que sea un injerto duradero y conducir a una mejor supervivencia.
Este estudio es una revisión de los resultados del TMO en pacientes pediátricos con enfermedades no malignas que fueron tratados en nuestro centro.
El objetivo primario fue determinar la sobrevida global (SG) a los 36 meses del TMO. Los objetivos secundarios fueron analizar la frecuencia de falla del injerto, de enfermedad de injerto contra huésped (EICH).y la mortalidad relacionada al trasplante.
MATERIALES Y MÉTODOS
El presente estudio es observacional y descriptivo. La investigación fue llevada a cabo con los pacientes del Servicio de Hematología y Oncología del Hospital Privado Universitario de Córdoba.
Se analizaron las historias clínicas de los pacientes menores de 18 años que recibieron TMO por presentar diagnóstico de inmunodeficiencia, metabolopatía, hemoglobinopatía y fallo medular congénito entre el año 1999 y el año 2016.
El rechazo primario del injerto se definió como el fracaso para establecer la reconstitución hematopoyética después del aloinjerto, mientras que la falla secundaria del injerto se definió como recuento absoluto de neutrófilos menor a 500 /mL después de la recuperación inicial de neutrófilos.
La EICH, de acuerdo con criterios de consenso del NIH (National Institute of Health), se definió de forma aguda cuando ocurre hasta el día +100 post-TMO, mientras que la crónica cuando ocurre después de dicho intervalo de tiempo (7). La EICH también se clasificó de acuerdo a la severidad clínica en grados de I a IV.
La mortalidad relacionada con el trasplante (MRT) se definió como la mortalidad de cualquier causa directamente relacionada con el régimen de acondicionamiento o debido al rechazo del injerto en los primeros 100 días post trasplante.
Las variables continuas se describieron como medianas (rango). La estimación de la SG se realizó mediante el método de Kaplan-Meier. Se utilizó el software estadístico StatsDirect.
Al ser un estudio retrospectivo, observacional y descriptivo, y que por lo tanto no implicó ninguna intervención ni riesgos en los pacientes estudiados, no fue necesaria la formulación de un consentimiento informado. Se preservó la identidad y privacidad de los datos de los participantes.
RESULTADOS
Entre los años 1999 y 2016 se realizaron 25 TMO en pacientes pediátricos con enfermedades no malignas. Diecinueve sujetos (76%) eran varones y 6 (24%) niñas. La mediana de edad fue de 3 años (rango: 0-16). 11 (44%) fueron diagnosticados con ID, 7 (28%) pacientes con TMH, 4 (16%) con hemoglobinopatías y 3 (12%) con diagnóstico de AF.
De las 25 TMO, 6 (24%) fueron de donante relacionado y 19 (76%) de donante no relacionado. Las decisiones sobre el régimen de acondicionamiento, el tratamiento de profilaxis contra la EICH y las medidas de soporte se basaron en la enfermedad subyacente, el tipo de donante y la fuente de trasplante según los protocolos vigentes en la institución. Casi todos los pacientes utilizaron regímenes de acondicionamiento mieloablativos. Veinte utilizaron regímenes con busulfán. Solo un paciente con diagnóstico de inmunodeficiencia combinada severa se trasplantó sin acondicionarse.
Con respecto a la profilaxis de EICH, en 22 pacientes se indicó ciclosporina, de los cuales a 13 se les asoció metotrexate, a 3 meprednisona y el resto sin asociaciones. Dos pacientes recibieron tacrolimus. Las dosis fueron ajustadas según concentraciones séricas. Los pacientes que realizaron TMO de donante no relacionado recibieron globulina antitimocítica (ATG) como parte del condicionamiento para profilaxis de EICH.
Las fuentes de rescate utilizadas fueron: médula ósea en 14 pacientes (56%), sangre periférica en 2 (8%), y cordón umbilical en 9 (36%).
La falla del injerto ocurrió en 4 pacientes (16%), 2 de ellos presentaron diagnóstico de ID primaria uno talasemia mayor y uno mucopolisacaridosis. Los cuatro pacientes recibieron acondicionamientos mieloablativos. Tres de ellos fueron trasplantados a partir de un donante no relacionado y uno de sangre del cordón umbilical.
Once pacientes (44%) presentaron EICH aguda, y sólo 1 (4%) crónica. Sólo en 2 casos (8%) la EICH fue severa (G III-IV).
De los 10 pacientes fallecidos, 9 ocurrieron dentro de los primeros 100 días post-trasplante. Las causas de mortalidad fueron infecciosas en 5 pacientes, EICH severa en 2 pacientes y enfermedad veno-oclusiva en 2 pacientes. La mortalidad relacionada al trasplante fue de 36%.
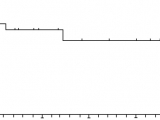
La SG estimada a los 36 meses del trasplante fue de 58,45% (Figura 1)
|
Tiempo de seguimiento (Meses) |
|
Probabilidad de Sobrevida |
DISCUSION
Nuestro principal objetivo fue evaluar el resultado del TMO en pacientes con enfermedades no malignas.
A pesar de los regímenes de acondicionamiento intensivo en pacientes con trastornos hematológicos no malignos, el rechazo primario o secundario del injerto puede ocurrir. El rechazo generalmente ocurre con o sin recuperación de la médula ósea del paciente y la restauración de la enfermedad original. La tasa de falla del injerto después de TMO alogénico es estimado en general alrededor del 5%.
En el estudio publicado por Mouhab y cols (8) en Arabia Saudita, de los 541 pacientes pediátricos sometidos a TMO alogénico por trastornos no malignos, 114 de ellos desarrollaron falla del injerto (21%).
En el año 2004, Petter Svenberg y cols (9) en su trabajo donde incluyeron a 25 pacientes con trastornos no malignos (anemia aplásica severa y errores innatos metabolismo), que se sometieron a TMO alogénico de donantes no relacionados, demostraron que la incidencia acumulada de EICH agudo grado II a IV fue del 24%, mientras que la enfermedad crónica ocurrió en el 21%.
Otro estudio en donde se incluyeron 13 pacientes pediátricos con trastornos no malignos sometidos a TMO de intensidad reducida, en el Children's Memorial Hospital en Chicago, Estados Unidos, entre el 2000 y 2004, la incidencia de EICH aguda grado II-IV fue del 8% (10).
El análisis de EICH es difícil ya que en nuestro estudio hubo diferentes tipos de donantes y por lo tanto diferentes regímenes de profilaxis de EICH. Si bien en nuestro trabajo la incidencia de EICH aguda fue mayor, no dejan de ser valores aceptables.
Con respecto a la MRT en la publicación de David Jacobsohn y colaboradores (10), nuestros datos se comparan favorablemente con el resultado de los pacientes con diagnósticos no malignos que se sometieron a TMO en su institución, desde 1992 hasta que comenzaron a utilizarse regímenes de intensidad reducida. De 21 pacientes que recibieron terapia mieloablativa seguida de TMO (la mayoría tenía hermano emparentado o sangre del cordón umbilical no relacionada), 7 (33%) murieron por causa relacionada con el trasplante antes de los 100 días. Posteriormente se estudiaron 13 pacientes que fueron sometidos a regímenes de acondicionamiento de intensidad reducida; dos pacientes (15,3%) murieron antes del día 100 post trasplante. Las causas de muerte fueron enfermedad subyacente e infección viral.
En relación a la sobrevida global, en los últimos años los trabajos publicados comparan regímenes mieloablativos con regímenes de intensidad reducida. En la publicación de Ringden y colaboradores (11) se administraron acondicionamiento a base de fludarabina (FBC) a 24 pacientes y condicionamiento mieloablativo convencional (MC) a 33 pacientes. La mayoría de los niños presentaban enfermedad hematopoyética no maligna. La supervivencia a 5 años fue de 89 y 85% en los grupos FBC y MC, concluyendo que aunque la supervivencia fue similar, FBC es una alternativa prometedora a MC en trastornos no malignos.
CONCLUSIÓN
Aunque el número de pacientes es escaso y los datos son heterogéneos, la sobrevida global es inferior a la de otras publicaciones, pero es aceptable. Si bien la falla del injerto ocurrió en un porcentaje no despreciable de los casos, fue similar a la observada en publicaciones previas. La MRT fue comparable a los estudios realizados con pacientes que recibieron acondicionamientos mieloablativos. La principal causa de muerte fue la infecciosa. Nuestro estudio sugiere que en los pacientes con trastornos no malignos el TMO es una opción a tener en cuenta, pero se necesitan de estudios comparativos para generalizar estos hallazgos.
Bibliografía
1. Mahmoud HK, Elhaddad AM, Fahmy OA, Samra MA, Abdelfattah RM, El-Nahass YH, et al. Allogeneic hematopoietic stem cell transplantation for non-malignant hematological disorders. J Adv Res. 2015; 6(3): 449-582. Xu L, Chen H, Chen J, Han M, Huang H, Lai Y, et al. The consensus on indications, conditioning regimen, and donor selection of allogeneic hematopoietic cell transplantation for hematological diseases in China—recommendations from the Chinese Society of Hematology. J Hematol Oncol 2018; 11: 33.
3 Sullivan KM, Parkman R, Walters MC. Bone Marrow Transplantation for Non-Malignant Disease. ASH Education Program Book 2000; 2000: 319-38.
4. Hladun R, Badell I, González M, Martínez AM, Sánchez de Toledo J, Olivé MT, et al. Análisis de la supervivencia de los niños con inmunodeficiencias primarias que han recibido un trasplante de progenitores hematopoyéticos en España. An Pediatr 2015; 82: 62-7.
5 Carreras E, Dufour C, Mohty M, Kroger N. The EBMT handbook: Hematopoietic Stem Cell traplantation and Cellular Therapies. Springer; 2012.
6. Saba N, Flaig T. Bone marrow transplantation for nonmalignant diseases. J Hematother Stem Cell Res 2002; 11(2): 377-87.
7. Przepiorka D, Weisdorf D, Martin P, Klingemann HG, Beatty P, Hows J, et al. 1994 Consensus conference on acute GVHD grading. Bone Marrow Transpl 1995; 15(6): 825-8.
8. Ayas M, Al-Jefri A, Eldali A, Al-Seraihi A, Al-Mahr M, Al-Ghonaium A, et al. Outcome of Second Allogenic Stem Cell Transplantation in Pediatric Patients with Non-Malignant Hematological and Immune Deficiency Disorders. Pediatr Blood Cancer 2011; 56: 289-93
9. Svenberg P, Remberger M, Svennilson J, Mattsson J, Leblanc K, Gustafsson B, et al. Allogenic Stem Cell Transplantation for Nonmalignant Disorders Using Matched Unrelated Donors. Biol Blood Marrow Transplant 2004; 10: 877-82.
10. Jacobsohn DA, Duerst R, Tse W, Kletzel M. Reduced intensity haemopoietic stem-cell transplantation for treatment of non-malignant diseases in children. Lancet 2004; 364: 156-62.
11. Ringden O, Remberger M, Svenberg P, Svahn BM, Dahllöf G, Gustafsson B, et al. Fludarabine-based disease-specific conditioning or conventional myeloablative conditioning in hematopoietic stem cell transplantation for treatment of non-malignant diseases. Bone Marrow Transplant 2007; 39: 383-8.