Volumen 2, Nº 36 | 2018
Oxigenoterapia de alto flujo calentado y humidificado en pediatría y neonatología en pacientes internados en Hospital Dr. Guillermo Rawson, San Juan - Humidified and heated high flow nasal cannula oxygen therapy in pediatrics and neonatology in Guillermo Rawson Hospital, San Juan
Laura Beatriz Polliotto, Cecilia Peñafort, Cristina Ciallella
Palabras clave: insuficiencia respiratoria, insuficiencia respiratoria aguda hipoxémica, oxigenoterapia nasal de alto flujo, cánula nasal de alto flujo, ventilación no invasiva.
Keywords: respiratory insufficiency, acute hypoxemic respiratory failure, high-flow nasal oxygen, high-flow nasal cannula, noninvasive ventilation.
INTRODUCCIÓN
La falla respiratoria aguda es causa de hospitalización en la población pediátrica y la oxigenoterapia es una medida terapéutica administrada en la insuficiencia respiratoria hipoxémica. Aunque no reduce el trabajo respiratorio, ni mejora la ventilación alveolar.
La insuficiencia respiratoria aguda (IRA) se puede clasificar, de acuerdo con el principal componente de los gases en sangre arterial alterados en: IRA de Tipo I o hipoxémica, (caracterizada por PaO2 <60mmHg con PaCO2 normal o baja) y en IRA de Tipo II o hipercápnica (se manifiesta con PaCO2 >50 mmHg, por lo general asociada a PaO2 disminuida, respirando aire ambiente).
Lo primero que descartamos en un paciente con IRA es la necesidad de ventilar; evaluamos si presenta respiración espontánea y la permeabilidad de su vía aérea (1).
La ventilación mecánica (VM) es un recurso terapéutico de soporte vital, que soporta la oxigenación y ventilación, facilitando el intercambio gaseoso y el trabajo respiratorio en pacientes con insuficiencia respiratoria. Se puede administrar en forma invasiva con intubación (VMI) o no invasiva (VMNI) con diferentes interfases (2).
La VMNI es una modalidad de soporte respiratorio que permite incrementar la ventilación alveolar sin invadir la vía aérea del paciente más allá de las cuerdas vocales. El ahorro de las complicaciones causadas por la intubación traqueal la hace especialmente atractiva en pacientes con IRA, que conservan cierta autonomía respiratoria (3).
El soporte mediante presión positiva continua en la vía respiratoria (CPAP) en neonatología reduce el trabajo respiratorio, pero no contribuye a la ventilación.
La oxigenoterapia con cánula nasal de alto flujo calentado y humidificado (OAFC y H) surge como modo de soporte ventilatorio no invasivo alternativo, o paso previo a la VMNI. La evidencia demostró que la presión que genera durante todo el ciclo respiratorio, es más elevada durante la espiración que durante la inspiración y genera como máxima medida el equivalente a un valor de CPAP de 5 cm de agua (4).
La OAFC y H es suministrada a pacientes con IRA hipoxémica no hipercápnica (Tipo I), que no se controla con oxigenoterapia estándar (5). Por su mecanismo de acción y su fácil aplicación, se incrementó su uso en pacientes hospitalizados pediátricos y en salas de emergencia, evitando en algunos casos el ingreso a unidades de mayor complejidad (6-8). Estos dispositivos permiten administrar mezcla de aire y oxígeno calentado y humidificado, con flujos elevados, que dan un cierto nivel de presión positiva en la vía aérea, cubriendo las demandas de flujo pico inspiratorio del paciente, superior a la demanda inspiratoria espontánea de éste (9). Además, entrega una fracción de oxígeno inspirada (FiO2) conocida y estable entre 21% hasta 100%, con un caudal de hasta 60 L/min. Para evitar dañar la vía aérea, estos dispositivos ofrecen una humedad relativa entre 95-100% a una temperatura corporal de 34-37°C. Aportan 1 a 2 L/min (en neonatos), 6 L/min hasta 60 L/min (en lactantes, niños y adultos) a través de cánulas nasales, consiguiendo alivio de los síntomas debido a sus diferentes mecanismos de acción, que ejercen efectos en el sistema respiratorio, incluyendo:
- Lavado de espacio muerto nasofaríngeo, optimizando la oxigenación y ventilación alveolar y atenuación de la resistencia inspiratoria.
- Mejora la conductancia, la distensibilidad pulmonar, la presión de distensión.
- Reduce el gasto energético por acondicionamiento del gas inhalado.
- Cambios en el volumen circulante.
- Genera cierto grado de presión positiva continua en la vía aérea. Esta presión es variable y está relacionada con el tamaño de las cánulas, del paciente (fugas boca abierta-cerrada) y de la efectividad de la humedad y del calor.
- Mayor tolerancia y confort (comparado con CPAP o VNI).
La cánula disponible para proveer alto flujo de oxigeno facilita una adecuada posición en la cara del paciente, evitando la obstrucción total de la narina y permitiendo una fuga variable de gas. Los sistemas que pueden cumplir con estos requisitos están constituidos por una cánula nasal de silicona, cuya conexión distal se halla unida a un circuito ventilatorio, calentado y humidificado, y un regulador de presión conectada a un mezclador aire /oxígeno (Figura 1).
El uso de OAFC y H, continúa siendo uno de los recursos más descriptos en el manejo de los pacientes con IRA Tipo I, que no responden a oxigenoterapia convencional y no reúnen criterio clínico ni gasométrico para VMI (10, 11). Considerando la evidencia que respalda su equivalencia clínica con otras modalidades de ventilación no invasiva, comenzamos a utilizar estos dispositivos a partir de setiembre de 2016 y reportamos su respuesta con los datos obtenidos hasta enero 2018 (12, 13).
El objetivo del estudio fue reportar la respuesta clínica con el uso de OAFC y H con cánula nasal, en pacientes con IRA Tipo I, internados en Terapia Intensiva Neonatal, Pediátrica y sala común, en nuestro hospital y evaluar su efectividad, para disminuir los mecanismos de ingreso a modos más complejos de asistencia ventilatoria mecánica.
MATERIALES Y METODOS
Se realizó un estudio retrospectivo y descriptivo. Se incluyeron todos los pacientes con diagnóstico de IRA hipoxémica no hipercápnica, con requerimiento de FiO2 <40% y un grado de dificultad respiratoria leve a moderado, hospitalizados, que recibieron OAFC y H con el sistema Fisher & Paykel en nuestra institución desde septiembre de 2016 hasta enero de 2018. Se excluyeron los neonatos menores a 38 semanas de edad gestacional, con un peso inferior a 2.500 g ya que estos sistemas necesitan una fuga peri cánula variable, y aún hay incertidumbre sobre la presión espiratoria final exacta que se genera en orofaringe en recién nacidos pretérmino (14).
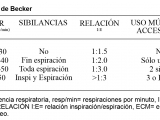
La severidad de la dificultad respiratoria se evaluó con los puntajes clínicos cuantificados con las escalas de Tal en menores de 6 meses, Wood Downes y Becker en pacientes mayores según edad y diagnóstico (Tabla 1). Se utilizaron planillas de registro donde consta número de identificación del paciente, edad, peso, diagnóstico, frecuencia respiratoria (FR), frecuencia cardíaca (FC), saturación de oxígeno arterial (SaO2), fracción inspirada de oxígeno (FiO2), presión arterial de oxígeno (PaO2), presión arterial de dióxido de carbono (PaCO2), auscultación, uso de músculos accesorios, y puntajes según score de gravedad de la insuficiencia respiratoria. Todos los controles se llevaron a cabo al ingreso, a las dos horas y diariamente hasta el destete. Los mismos fueron realizados exhaustivamente por kinesiólogos.
Se utilizaron cánulas nasales siliconadas, con oclusión de narinas menor al 50% de la superficie nasal (15). La determinación de la conexión se tomó en conjunto con el criterio médico y kinésico cuando la clínica del paciente no requería otro sistema de apoyo ventilatorio con mayor nivel de presión (16). Si bien en algunos pacientes al momento de administrarles la terapia con OAFC y H no disponíamos de los resultados de laboratorio de gasometría arterial, se consideraron hipoxémicos aquellos con oximetría menor a 90% y dificultad leve a moderada. La instauración de OAFC y H implicó vigilancia estrecha de los pacientes con monitorización adecuada (SatO2, frecuencia cardíaca, frecuencia respiratoria, gasometría) y valoración de la respuesta clínica. Si en las primeras dos horas, tras optimizar la OAFC y H, no se observaba mejoría clínica, no se demoró la aplicación de otras medidas de soporte (17-19). Todos cumplieron con el esquema terapéutico médico acorde a la clínica.
Se utilizaron dispositivos Fisher & Paykel Healthcare® con cánula nasal Optiflow (adecuada al peso y flujo aportado); unida a un circuito RT 330 Fisher & Paykel Healthcare® conectado a un humidificador MR 810 medix. Mezclador de aire y oxígeno o flujímetro de aire-oxígeno para generar la mezcla, logrando hasta 30 L/min. La FiO2 fue titulada de acuerdo a saturometría con oximetría de pulso. Se comenzó con un flujo inicial de 2 L/kg/min y FiO2 inicial mínima necesaria para lograr adecuada oxigenación a temperatura de 37°C. El destete comenzó cuando los parámetros clínicos y gasométricos mejoraron (FR y oxigenación). Gradualmente se redujeron la concentración de oxígeno hasta una FiO2 (por debajo de 50%), y paulatinamente el flujo de 2 en 2 en función de la mecánica respiratoria hasta llegar a 4L/min, a partir de ahí se colocó cánula nasal convencional.
La eficacia del tratamiento se estimó según el éxito o fracaso de la terapia. Las variables consideradas fueron: edad, severidad de la dificultad respiratoria, saturación de oxígeno y requerimiento de oxígeno adicional. Se consideró éxito al descenso de 2 puntos o más de la puntuación clínica de gravedad (según escalas o scores), disminución de la FR, y del trabajo respiratorio, aumento de la SaO2 y mejoría gasométrica en las primeras 2 horas de iniciado el tratamiento. Se consideró fracaso a la constatación de taquipnea, mayor hipoxemia, asincronía tóraco-abdominal, progresión de la insuficiencia respiratoria, intolerancia a los flujos entregados por más de una hora, u otra complicación que imposibilitara la continuidad de la terapia y la necesidad de cambiar a un modo de asistencia respiratoria alternativa con mayor nivel de presión. VMNI o requerimiento de intubación endotraqueal. La decisión de intubación quedó a criterio médico según la evaluación clínica y gasometría arterial.
RESULTADOS
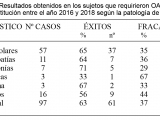
Se analizaron 97 pacientes, 11 neonatos y 86 pediátricos entre 2016 y 2018. Las características basales se resumen en la Tabla 2.
Del total de pacientes que utilizaron OAFC y H, 61 (63%) fueron respondedores y 36 pacientes (37%) empeoraron y necesitaron otro tipo de apoyo ventilatorio (Tabla 3).
De estos 36 pacientes que no respondieron al tratamiento; 26 pacientes (73%) necesitaron VMNI y 10 pacientes (26%) debieron ser intubados (Tabla 4).Los pacientes respondedores que ingresaron a OAFC y H con un score promedio de 7 puntos, mantuvieron mismo puntaje a la hora y/o disminuyeron su dificultad respiratoria 2 puntos por debajo del ingreso. La mediana de días de pacientes exitosos fue 4 (rango intercuatilo 2-6) como único soporte ventilatorio y los que fracasaron 1 día.
La OAFC y H permitió mejorar el trabajo respiratorio evaluado por la disminución de la disnea, FR y un incremento en la oxigenación y ventilación cuantificada en los gases arteriales y saturación de oxígeno. Mayor aceptación y comodidad frente a las máscaras de VNI y CPAP. No se registraron efectos indeseables ni complicaciones relacionadas a su utilización.
DISCUSIÓN
Numerosos estudios determinaron los beneficios potenciales de OAFC y H en recién nacidos y pacientes pediátricos, que cursan con alguna dificultad respiratoria hipoxémica sin hipercapnia, cuando se compara con oxigenoterapia convencional (20,21). Los resultados clínicos obtenidos son concordantes con otros estudios pediátricos donde se utilizó OAFC y H en IRA. La presión generada, mínima no controlada de CPAP entre 3-5 cmH2O, y FiO2 estable, minimizó el deterioro de las estructuras nasofaríngeas, disminuyendo el esfuerzo del paciente y permitiéndole alimentarse por vía oral sin dificultad (22,23).
Las dificultades en la implementación estuvieron relacionadas a la accesibilidad inmediata al equipo, a la disponibilidad de cánulas adecuadas a las narinas del paciente y material necesario para su correcta aplicación. Dado el escenario en que se implementó la OAFC y H; no tuvimos mayores inconvenientes en la falta de disponibilidad de los resultados de gases, y nos guiamos por los scores de dificultad y oximetría de pulso (menor a 90%) al ingreso. Podría usarse también como soporte ventilatorio alternativo en neonatología, con un enfoque crítico con respecto a respuestas clínicas efectivas, reconociendo tempranamente el fracaso del tratamiento. Teniendo en cuenta que aún persisten controversias debido a la escasa evidencia para evaluar la seguridad y eficacia en este grupo etario (24, 25).
Como conclusión, en pacientes pediátricos seleccionados (con IRA tipo I, con un score de dificultad respiratoria inferior a 7 puntos que no revierte con oxigenoterapia convencional, con vía aérea estable y usándola precozmente) la OAFC y H podría ser utilizada para disminuir o evitar la necesidad de VMI o VMNI.
Bibliografía
1. Pastor V, Pérez TS, Rodríguez Cimadevilla JL. Fracaso respiratorio agudo y crónico Oxigenoterapia. Protoc diagn ter pediatr. 2017;1: 369-99.2. Canepari A y Retta A. Interfases en pediatría. En: SATI (Sociedad Argentina de Terapia Intensiva) / Comité Pediátrico de Neumonología Crítica Ventilación mecánica en pediatría. Manual del curso de ventilación mecánica en pediatría. Buenos Aires: Editorial Panamericana; 2014.
3. Diez AR, Abbona H, Ferrero G, Figueroa Casas JC, De Vega M, Lopez AM, et al. Consenso Argentino De Ventilación No Invasiva. Medicina (B Aires). 2005; 65: 437-57.
4. Parke R, McGuinness S, Eccleston M. Nasal high-flow therapy delivers low level positive airway pressure. Br J Anaesth. 2009; 103: 886-90.
5. Schmid F, Olbertz DM, Ballmann M. The use of high-flow nasal cannula (HFNC) as respiratory support in neonatal and pediatric intensive care units in Germany–A nationwide survey. Respir Med. 2017; 131: 210-14.
6. Wegner A, Cespedes F P, Godoy M ML, Erices B P, Urrutia C L, Venthur U C, Labbé C M, et al. High flow nasal cannula in infants: Experience in a critical patient unit. Rev Chil Pediatr 2015; 86: 173-81.
7. Ward JJ. High Flow oxygen administration by nasal cannula for adults and perinatal patients. Respir Care. 2013; 58: 98-122.
8. Katherine S, Steven A, Rotta J. The use of high-flow nasal cannula in the pediatric emergency department. Pediatr. 2017; 93: 36-45.
9. Dysart K, Miller TL, Wolfson MR, Shaffer TH. Research in high flow therapy: Mechanisms of action. Respir Med. 2009; 103: 1400-5
10. Bermúdez Barrezueta L, García Carbonell N, López Montes J, Gómez Zafra R, Marín Reina P, Herrmannova J, et al. Oxigenoterapia de alto flujo con cánula nasal en el tratamiento de la bronquiolitis aguda en neonatos. An Pediatr (Barc). 2017; 86: 37–44.
11. Renda T, Corrado A, Iskandar G, Pelaia G, Abdalla K, Navalesi P. High-flow nasal oxygen therapy in intensive care and anaesthesia. Br J Anaesth. 2018; 120: 18-27.
12. Lampland AL, Plumm B, Meyers PA, Worwa CT, Mammel MC. Observational study of humidified high-flow nasal cannula compared with nasal continuous positive airway pressure. J Pediatr. 2009; 154: 177-82.
13. Roca O, Riera J, Torres F, Masclans JR. High-Flow Oxygen Therapy in Acute Respiratory Failure. Respir Care. 2010; 55(4): 408-13.
14. Fernández BA, Pajares MR, Mateos GA, Grande MP, Aguado IC. Sistemas de ventilación no invasiva de alto flujo en neonatología. Revisión y aproximación a su utilización en hospitales de la comunidad de Madrid. Acta Pediatr Esp. 2014; 20: 72-4.
15. Torres SF, Franco AC. Terapias de alto flujo en la insuficiencia respiratoria aguda en Pediatría. Medicina intensiva. 2013; 30:1-5.
16. Schibler A, Pham TMT, Dunster KR, Foster K, Barlow A, Gibbons K, et al. Reduced intubation rates for infants after introduction of high-flow nasal prong oxygen delivery. Intensive Care Med. 2011; 37: 847-52.
17. Hoffman B, Terrell N, Driscoll C. Impact of High-Flow Nasal Cannula Use on Neonatal Respiratory Support Patterns and Length of Stay. Respir Care. 2016; 61:1299-304.
18. Manley DJ, Dold SK, Davis PG, Roehr CC. High-flow nasal cannula for respiratory support of preterm infants: a review of the evidence. Neonatology.2012; 102: 300-8.
19. Ricard JD. High flow nasal oxygen in acute respiratory failure. Anaesth. 2012; 78: 836-841.
20. Ramnarayan P, Schibler A. Glass half empty or full The story of high-flow nasal cannula therapy in critically ill children. Intensive Care Med. 2017;43: 246-9.
21. Woodhead DD, Lambert DK, Clark JM, Christensen RD. Comparing two methods of delivering high-flow gas therapy by nasal cannula following endotracheal extubation: a prospective, randomizaed, masked, crossover trial. J. Perinatol. 2006; 26: 481-85.
22. Parke RL, McGuinness SP. Eccleston M. A preliminary randomized controlled trial to assess effectiveness of nasal high-flow oxygen in intensive care patients. Respir Care. 2011; 56: 265-70.
23. Frat JP, Thille AW, Mercat A, Girault C, Ragot S, Perbet S, et al. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. N Engl J Med. 2015; 372: 2185-96.
24. Sztrymf B, Messika J, Bertrand F, Hurel D, Leon R, Dreyfuss D, et al. Beneficial effects of humidified high flow nasal oxygen in critical care patients: A prospective pilot study. Intensive Care Med. 2011; 37: 1780-6.
25. Wilkinson D, Andersen C, Smith K, Holberton J. Pharyngeal pressure with high-flow nasal cannulae in premature infants. J Perinatol. 2008; 28: 42-7.