Volumen 34, Nº 2 | 2016
Manejo del sangrado por varices esofágicas en pacientes con cirrosis - Management of esophageal variceal bleeding in patients with cirrhosis
Adria Carpio, Andrés Cárdenas
Palabras clave: Várices esofágicas, Hemorragia digestiva alta; TIPS; Terlipresina
Keywords: Esophageal varices, Upper gastrointestinal bleeding, TIPS, telipressin
CRIBADO Y PREVENCIÓN DEL PRIMER EPISODIO DE SANGRADO
El cribado de várices esofágicas se define como la búsqueda activa de várices en pacientes con enfermedad hepática, ya sea compensada o descompensada, con riesgo de desarrollo de estas. Pese al avance de técnicas no invasivas, el cribado de várices esofágicas sigue siendo invasivo en la mayoría de pacientes y se realiza con una endoscopía digestiva alta. La aparición de várices esofágicas está íntimamente relacionada con el aumento del gradiente de presión venoso hepático (GPVH), que consiste en la diferencia de presiones entre la vena cava y las suprahepáticas. Este puede aumentar por causa prehepática, hepática o posthepática
Se considera hipertensión portal al aumento del GPVH por encima de 5 mmHg y clínicamente significativo cuando este supere los 10 mmHg. Es en este momento cuando hay riesgo de aparición de las complicaciones propias de ella, como la ascitis, la encefalopatía hepática y las varices gastroesofágicas. Por definición, los pacientes sin hipertensión portal clínicamente significativa (GPVH <10 mmHg) no están en riesgo de desarrollar varices esofágicas y por ello no debe realizarse cribado de estas activamente. La eliminación de la causa de enfermedad hepática (abstinencia enólica, respuesta viral sostenida en hepatopatía por virus, cambio de hábitos en NASH) puede reducir el GPVH, por lo que deberá ser el objetivo final en estos pacientes. No se ha demostrado que el uso de betabloqueantes no selectivos (BBNS) reduzca el riesgo de aparición de várices en esta población por lo que su uso no está recomendado en ellos.
En pacientes con hipertensión portal clínicamente significativa (HTPCS) pero con una enfermedad hepática compensada, con >150.000 plaquetas y una elasticidad hepática realizada por Fibroscan menor de 20 Kpa, el riesgo de desarrollo de várices es muy bajo y por ello tampoco deberá realizarse cribado activo de estas ni tratamiento con BBNS para evitar su aparición. En el resto de pacientes deberá realizarse cribado activo mediante una endoscopía digestiva alta en el momento del diagnóstico de la enfermedad hepática. Se distinguirá el hallazgo de várices pequeñas, grandes y con/sin signos de riesgo (Tabla 1 y Figura 1).
Según el resultado se actuará de una manera u otra:
1) En pacientes sin várices en los que la causa de su hepatopatía ha sido resuelta y si tienen factores de riesgo deberá repetirse el cribado endoscópico en tres años.
2) En pacientes sin várices, pero en los que la causa de su hepatopatía no ha sido eliminada (enolismo activo, no curación del virus, obesidad u otros factores de riesgo para la NASH) deberá repetirse el cribado endoscópico en dos años.
3) En pacientes compensados con várices pequeñas (<5 mm de diámetro horizontal) en los que la causa de su hepatopatía ha sido resuelta y sin factores de riesgo deberá repetirse el cribado endoscópico en dos años.
4) En pacientes compensados con várices pequeñas, pero en los que la causa de su hepatopatía no ha sido resuelta deberá repetirse el cribado endoscópico en un año.
5) En pacientes con várices pequeñas, pero con signos de riesgo (puntos rojos) o con enfermedad hepática descompensada (Child-Pugh C) se debe iniciar tratamiento profiláctico primario con BBNS.
6) En pacientes con varices grandes (>5 mm de diámetro horizontal) se deberá iniciar profilaxis primaria, bien sea farmacológica (BBNS) o con ligadura endoscópica (LEB) (Figura 2). El uso de uno u otra dependerá de la tolerancia del paciente a los BBNS y de la disponibilidad y experiencia del centro con la LEB.
TRATAMIENTO FARMACOLÓGICO
El tratamiento farmacológico para la prevención del sangrado por várices consiste en el uso de betabloqueantes no selectivos (BBNS), en concreto el propranolol y el nadolol que han demostrado reducir el GPVH y por tanto reducir la progresión y riesgo de sangrado de las várices. El carvedilol, un alfa-antagonista, ha demostrado reducir de forma más intensa el GPVH, pero no ha sido comparado contra los BBNS en estudios clínicos suficientemente relevantes por lo que su uso no puede recomendarse sobre los demás. Su uso vendrá determinado por la tolerabilidad de sus efectos secundarios, en especial la hipotensión y la bradicardia.
El efecto de los BBNS se puede medir con la reducción del GPVH, considerándolo relevante cuando su uso crónico venga acompañado de una reducción del GPVH o bien >10%, o bien con un descenso por debajo o igual de los 12 mmHg. El efecto relevante tendrá un impacto directo sobre el riesgo de sangrado y la progresión de las várices. Igualmente lo podremos medir con la medición directa del GPVH tras la administración de propranolol endovenoso, tomando en cuenta los mismos criterios mencionados. En pacientes no respondedores a los BBNS clásicos puede intentarse el tratamiento con carvedilol.
En pacientes con enfermedad hepática avanzada, en especial los que presentan ascitis refractaria, peritonitis bacteriana espontánea o insuficiencia renal su uso puede estar contraindicado, debiendo o bien reducir su dosis o bien suspenderlo. En caso de no poder reiniciarlos por persistencia de dichas condiciones, se deberá seguir con la profilaxis primaria endoscópica (LEB) .
TRATAMIENTO ENDOSCÓPICO
La ligadura con bandas endoscópica es un método válido de profilaxis primaria, en especial en pacientes intolerantes a los BBNS. Su uso vendrá determinado por su disponibilidad y la experiencia en el centro. Deberá realizarse periódicamente, dejando de dos a tres semanas para cicatrizar las heridas producidas, hasta lograr la erradicación de estas. Una vez lograda la erradicación habrá que realizar una endoscopía de control a los 3 meses, y si no hay realizar nuevo control a los 6 y 12 meses para confirmar su erradicación.
SANGRADO AGUDO POR VÁRICES ESOFÁGICAS
En ausencia de tratamiento, las várices esofágicas aumentan a un ritmo de un 5%/año hasta su ruptura, produciéndose en ese momento un sangrado digestivo alto por várices. Dicha complicación acarrea una importante mortalidad, bien sea por el shock hipovolémico que se produce, como por la descompensación de la hepatopatía de base asociada al episodio de sangrado. Deberá considerarse que todo sangrado digestivo alto en paciente con hepatopatía crónica será consecuencia de la hipertensión portal hasta que se demuestre lo contrario.
TRATAMIENTO
Dada la alta mortalidad debida tanto al propio shock hipovolémico como a las complicaciones secundarias al episodio de sangrado (en especial infecciosas en forma de traqueobronquitis/neumonía, translocación bacteriana con peritonitis bacteriana espontánea e insuficiencia renal), es importante tanto la prevención de éstas como el tratamiento del propio sangrado.
El tratamiento específico del episodio agudo de sangrado será tanto médico con fármacos vasoconstrictores esplácnicos como endoscópico. Se deberá iniciar el primero incluso antes que el segundo.
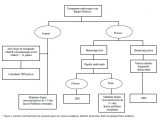
Así pues, habrá que recordar los siguientes puntos en todo paciente en que se sospeche de hemorragia digestiva alta secundaria a la hipertensión portal (Figs. 3 y 4):
1) Protección de la vía aérea si hay disminución del nivel de consciencia o vómitos copiosos de sangre roja para evitar broncoaspiraciones y facilitar el tratamiento endoscópico.
2) Estabilización hemodinámica del paciente, buscando TAS >100 mmHg para asegurar una perfusión periférica suficiente.
3) Uso racional de las trasfusiones de hemoderivados, buscando una Hb sérica entre 70 y 80 gr/L. Un estudio comparó el efecto de una política racional de transfusiones (buscando Hb entre 70-80 gr/L) y liberal (Hb >90gr/L), observando que en el grupo liberal existía mayor índice de resangrado a los 5 días, probablemente por el efecto paradójico de aumento de presión portal por hipervolemia. No obstante habrá que tener en cuenta las otras comorbilidades del paciente, como la cardiopatía isquémica, para poder definir mejor el objetivo transfusional.
4) El tiempo de protrombina no es una medición efectiva de la coagulopatía del paciente con hepatopatía crónica, dado el desbalance tanto de factores protrombóticos como antitrombóticos en estos pacientes. Atendiendo los datos actuales no se puede realizar una recomendación en cuanto a la corrección de la coagulopatía en el episodio de sangrado agudo, aunque se podría tratar cuando haya <50.000 plaquetas o el INR sea >1,5 teniendo en cuenta el riesgo/beneficio de dicha corrección.
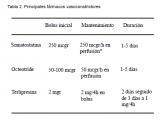
5) Como se ha mencionado previamente, todo sangrado digestivo alto en paciente con hepatopatía crónica conocida deberá considerarse secundario a la hipertensión portal hasta demostrarse lo contrario. Por ello deberá iniciarse tratamiento vasoconstrictor esplácnico específico incluso antes de realizar la endoscopía digestiva alta que confirme el origen del sangrado. Dicho tratamiento se realizará o bien con somatostatina, octreotido o terlipresina (Tabla 2):
- Somatostatina: antagonista del glucagón que produce una intensa vasoconstricción esplácnica y por tanto reduce el flujo portal, reduciendo el GPVH. Se iniciará con un bolus de 250 mcgr seguido de una perfusión continua a 250 mcgr/h, pudiendo doblar la velocidad de perfusión ante sospecha de persistencia del sangrado. Dicha perfusión se mantendrá entre 3 y 5 días. Sus principales efectos secundarios serán náuseas, vómitos e hiperglucemias.
- Octreotido: análogo de la somatostatina con una vida media más larga. Se iniciará con un bolus de 50-100 mcgr y se mantendrá una perfusión continua a 50 mcgr/h de 3 a 5 días. Como principal inconveniente presenta taquifilaxia de forma precoz.
- Terlipresina: análogo sintético de la vasopresina, produce también vasoconstricción del territorio esplácnico. Presenta un perfil de tolerabilidad mayor a la somatostatina, con menos efectos secundarios, mayor especificidad para el territorio esplácnico y una liberación lenta que permite su administración en bolus. Se iniciará con un bolus de 2 mg seguido de 2 mg/4h las primeras 48 horas y 1 mg/4h las siguientes 72 horas. Se ha observado que puede producir hiponatremia por lo que será necesario realizar una monitorización electrolítica minuciosa.
6) Dadas las complicaciones infecciosas previamente mencionadas, la profilaxis antibiótica es una parte integral del tratamiento en el episodio de hemorragia digestiva alta y deberá iniciarse en la admisión del paciente en el centro hospitalario. Hay que tener en cuenta tanto la epidemiología como los aislamientos anteriores. El tratamiento con norfloxacino es una opción válida siempre que el paciente no presente factores de riesgo para gérmenes resistentes a quinolonas ni realice profilaxis con ellas para peritonitis bacteriana espontánea. En pacientes con cirrosis avanzada (bilirrubina >3 mg/dL, ascitis o encefalopatía hepática), en situación de riesgo (shock), o con riesgo de gérmenes resistentes a quinolonas, se beneficiarán más con un tratamiento con ceftriaxona, 1 gr endovenoso.
7) Estudios recientes han demostrado que tanto la rifaximina como la lactulosa podrían prevenir la aparición de encefalopatía hepática en el episodio de sangrado agudo por várices, aunque serán necesarios más estudios para determinar el riesgo/beneficio de su administración y qué pacientes se pueden beneficiar más de ello.
8) Siempre que se sospeche de un sangrado digestivo alto secundario a la hipertensión portal, deberá realizarse una endoscopia digestiva alta. Esta se realizará una vez estabilizado el paciente e iniciado el tratamiento vasoconstrictor específico y antibiótico, en las primeras 12 horas desde la admisión en el centro hospitalario. Previo a ello es recomendable la administración de 250 mg endovenosos de eritromicina, de 30 minutos a 120 antes de la prueba, para estimular el vaciamiento gástrico, siempre que no haya contraindicaciones para ello (QT largo, etc.). Se considerará un sangrado por várices si se encuentran várices con sangrado activo (a chorro o en babeo), tetón de fibrina sobre una variz o várices con ausencia de otros puntos de sangrado en el tracto digestivo superior. El tratamiento endoscópico de elección para el sangrado por várices esofágicas será la ligadura con bandas endoscópica (LEB) que es superior a la escleroterapia.
9) Es recomendable ingresar a dichos pacientes en unidades de cuidados intensivos para una monitorización estrecha.
TIPS precoz
El TIPS (transjugular intrahepatic portosystemic shunt) consiste en un stent que crea un shunt artificial entre la circulación portal y sistémica, reduciendo drásticamente el gradiente de presión venosa hepática (GPVH), al crear un bypass entra la vena porta y una suprahepática. Actualmente los stents cubiertos de politetraflueroetilo (PTFE) son una opción segura y eficaz para lograr tal cometido. El TIPS precoz es la colocación de un TIPS en las primeras 72 horas tras el control del episodio agudo de sangrado por várices esofágicas en pacientes con alto riesgo de fallo del tratamiento. Son necesarios más estudios para definir mejor cuál es esta población de riesgo, aunque se acepta actualmente que pueda corresponder a pacientes con un Child-Pugh C de entre 10 y 13 puntos y Child-Pugh B con sangrado activo en el momento de la endoscopía). En un estudio observacional de 2010 se concluyó que la colocación de un TIPS precoz reducía drásticamente el índice de resangrado y aumentaba la supervivencia en este grupo de pacientes de riesgo sin aumentar el riesgo de encefalopatía u otras complicaciones relacionadas con el TIPS.
Fallo del tratamiento
Se considera fallo del tratamiento al resangrado por várices tras el inicio del tratamiento combinado endoscópico y farmacológico. Si sucede en los primeros cinco días se podría intentar realizar tratamiento endoscópico de nuevo. El balón de Sengstaken consiste en un balón expandible que recubre toda la superficie esofágica y cardial y que puede ayudar a controlar el fallo de tratamiento endoscópico primario o sangrados esofágicos masivos donde no sea posible el tratamiento con bandas elásticas. Se puede usar como tratamiento puente a la colocación de TIPS y se puede mantener hasta 24 horas. Presenta un riesgo de complicaciones muy elevado, en especial broncoaspiración, neumonía y perforación esofágica. Recientemente han aparecido stents de malla auto-expandibles esofágicos que podrían presentar un mejor perfil de seguridad que el balón de Sengstaken. En los demás casos la colocación de TIPS es el tratamiento más adecuado.
Prevención secundaria del sangrado por varices esofágicas
El riesgo de presentar un nuevo episodio de resangrado es sumamente elevado sin una profilaxis secundaria adecuada de por vida. Numerosos estudios han demostrado que la terapia combinada farmacológica y endoscópica (BBNS + LEB) presenta mejores resultados que la monoterapia. Por ello en todo paciente con un episodio de sangrado por várices esofágicas habrá que erradicar endoscópicamente las várices esofágicas y mantener tratamiento farmacológico de por vida con BBNS. Únicamente se planteará la monoterapia endoscópica con LEB cuando el paciente presente intolerancia/contraindicación al tratamiento médico con BBNS y contraindicación para un TIPS. Dado que el carvedilol no ha sido comparado con los BBNS en estos pacientes, actualmente no puede recomendarse como profilaxis secundaria del sangrado por várices esofágicas.
Recordar que en pacientes con enfermedad hepática avanzada y ascitis refractaria habrá que realizar una monitorización minuciosa de la presión arterial, sodio sérico y creatinina. Una tensión arterial sistólica menor de 90 mmHg, una natremia menor a 130 mEq/L o la aparición de insuficiencia renal deben obligarnos a parar el tratamiento médico. Si ha habido un desencadenante claro habrá que reiniciar el tratamiento con BBNS una vez resuelto el mismo. En caso de intolerancia habrá que reiniciar el BBNS a su dosis mínima para retitular la dosis idónea para el paciente. Si el paciente sigue presentando intolerancia a ello y es un candidato apropiado a la implantación de TIPS deberá considerarse su colocación como profilaxis secundaria.
Bibliografía
1. Roberto de Franchis, on behalf of the Baveno VI Faculty. Expanding consensus in portal hypertension Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015 Sep;63(3):743-52.2. Bosch J, García-Pagan JC, Berzigotti A, Abraldes JG. Measurement of portal pressure and its role in the management of chronic liver disease. Semin Liver Dis. 2006, 26(4):348-362.
3. Haycock A, et al. Cotton and Williams’ Practical Gastrointestinal Endoscopy. The Fundamentals. 7th Edition. pp. 67-68.
4. Villanueva C, Colomo A, Bosch A, Concepción M, Hernandez-Gea V, Aracil C, Graupera I, Poca M, Alvarez-Urturi C, Gordillo J, Guarner-Argente C, Santaló M, Muñiz E, Guarner C. Transfusion strategies for acute upper gastrointestinal bleeding. 2013, N Eng J Med. 2013 Jun 13(368): 11-21. Erratum in: N Engl J Med. 2013 Jun 13;368(24):2341.
5. Escorsell A, Bordas JM, del Arbol LR, Jaramillo JL, Planas R, Banares R, et al. Randomized controlled trial of sclerotherapy versus somatostatin infusion in the prevention of early rebleeding following acute variceal hemorrhage in patients with cirrhosis. Variceal Bleeding Study Group. J Hepatol. 1998 Nov;29(5):779-88.
6. Escorsell A, Ruiz-del-Arbol L, Planas R, Albillos A, Banares R, Cales P, et al. Multicenter randomized controlled trial of terlipressin versus sclerotherapy in the treatment of acute variceal bleeding: the TEST study. Hepatology. 2000 Sep;32(3):471-6.
7. Fernandez J, Ruiz-del-Arbol L, Gomez C, Durandez R, Serradilla R, Guarner C, et al. Norfloxacin vs ceftriaxone in the prophylaxis of infections in patients with advanced cirrhosis and hemorrhage. s.l. : Gastroenterology. 2006 Oct;131(4):1049-56.
8. Garcia-Pagan JC, Caca K, Bureau C, Laleman W, Appenrodt B, Luca A, et al. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med. 2010 Jun 24;362(25):2370-9.