Volumen 30, Nº 1 | 2012
Tumor fibroso gigante de pleura - Plural Solitary Fibrous Tumor
Facundo N Álvarez Padilla, Diego Debernardi, Sebastián Ávalos, Mario EF Bustos
Palabras clave:
Keywords:
INTRODUCCIÓN
El tumor fibroso solitario de pleura (TFSP) es una patología torácica poco frecuente. Representa el 8% de las lesiones benignas intratorácicas y menos del 10% de los tumores pleurales. Su incidencia se estima en 2,8 casos por 100.000 habitantes. [1,2] Se le confiere un origen mesenquimatoso, por lo que se debe hacer diagnóstico diferencial con otros tumores del mismo origen o con histopatología fusocelular, como son, los carcinomas sarcomatoides, los mesoteliomas saromatoides o desmoplásicos, los sarcomas sinoviales monofásicos, los fibrosarcomas y los leiomiosarcomas, para lo cual se requiere invariablemente del estudio histopatológico y de técnicas de inmunohistoquimica. [1]
Acorde con su comportamiento y su histología, los TFSP pueden ser benignos o malignos. Las variantes malignas presentan un crecimiento acelerado, un patrón infiltrativo y metástasis ganglionares al momento del diagnóstico. [1,2,3] Su descubrimiento, generalmente es incidental, en forma de nódulos pulmonares, únicos o múltiples y de tamaño variable en las radiografías de tórax. La mayoría de los casos son asintomáticos, pero pueden presentar tos, disnea y dolor torácico. Algunos pacientes, desarrollan un cuadro de hipoglucemia sostenida o manifestaciones osteoarticulares, que corresponden a síndromes paraneoplásicos por productos liberados por el tumor. [1,4,5]
El tratamiento es quirúrgico, pudiendo realizarse la extracción por toracotomía o por videotoracoscopía. [1,6] La sobrevida post-quirúrgica es buena, aun cuando, el riesgo de recidiva se mantiene latente durante largos períodos de tiempo. [2]
En el siguiente trabajo se presenta el caso de un TFSP gigante, el cual evolucionó en el tiempo sin tratamiento a causa de la negativa del paciente a la intervención quirúrgica, adquiriendo un tamaño tal, que el manejo quirúrgico resultó extremadamente dificultoso.
CASO CLÍNICO
Paciente de de 61 años, de sexo masculino, con diagnóstico de TFSP, que consulta a nuestra institución por un cuadro de disnea y dolor torácico progresivos que limitaban sus actividades cotidianas. En los últimos meses se desencadenaron, además, episodios de hipoglucemia sostenida de difícil manejo clínico.
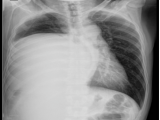
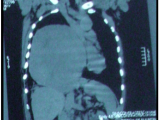
La radiografía de tórax demostró una lesión en hemitórax derecho, que ocupaba casi la totalidad de la cavidad, con aparente compromiso mediastinal. (Fig.1) Ante los hallazgos radiológicos, se solicitó una tomografía axial computada (TAC) de tórax, con contraste endovenoso que constató una masa voluminosa, que ocupaba las 2/3 partes del hemotórax derecho, de 204 mm x 198 mm x 173 mm. La lesión desplazaba las estructuras del mediastino hacia el hemitórax contralateral. No se constataron adenopatías mediastinales por este método. (Fig.2) Posteriormente, se realizó una resonancia magnética nuclear (RMN) de tórax, para determinar con mayor precisión los planos anatómicos que no aportó mayores datos que la TAC. Se practicó una biopsia por punción de la lesión, arribando al diagnóstico preoperatorio de TFSP. Con la técnica de inmunohistoquímica, la lesión fue positiva para vimentina, CD34, bcl-2 y p53.
En la evaluación pre-operatoria no se encontraron criterios de inoperabilidad, ni signos de irresecabilidad. Ante un paciente cada vez más comprometido funcionalmente por el crecimiento del tumor, se decidió realizar el tratamiento quirúrgico.
Durante el tiempo anestésico, se practicó una videofibrobroncoscopía que no evidenció compromiso traqueal, pero reveló compresión extrínseca del árbol bronquial derecho. Para el abordaje, se realizó una toracotomía anterolateral derecha, a nivel del quinto espacio intercostal, con resección de toda una costilla para mejorar la exposición debido al tamaño tumoral. La lesión incorporaba comprometía, el lóbulo inferior y medio del pulmón derecho, adhiriéndose además, al pericardio y al diafragma homolateral. El compromiso del parénquima pulmonar determinó la necesidad de realizar una bi-lobectomía pulmonar derecha, con abundante sangrado intraquirúrgico por la rica vascularización colateral. Las adherencias tumorales requirieron de una pericardiectomía parcial y una resección en cuña del diafragma para extraer la lesión. Se confeccionó una tienda pleural para disminuir el espacio residual, ya que el lóbulo remanente no ocupaba toda la cavidad pleural. El
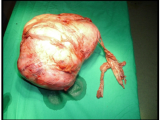
estudio anatomopatológico de la pieza quirúrgica confirmó el diagnóstico preoperatorio. (Fig. 3)
DISCUSIÓN
Los TFSP son tumores en su mayoría benignos. Su distribución anatómica es bastante heterogénea y pese a ser más frecuentes en el tórax, se han descrito casos en la cavidad abdominal, el peritoneo parietal y visceral, el retroperitoneo, el mesenterio, el pericardio, las meninges, el hígado, la glándula mamaria, el aparato digestivo, la tiroides, el tracto urinario e incluso a nivel ocular. [1,2,7,8,9] No se ha podido determinar su predominio en cuanto a género, ni relación directa con agentes carcinógenos comunes como el asbesto o el tabaco. [1] El diagnóstico generalmente es fortuito por estudios de imágenes. Los síntomas descriptos más frecuentemente son: tos (8 – 33%), disnea (11 – 25%), dolor torácico (17 – 23%). También, puede evidenciarse hemoptisis y pérdida de peso.
[1] El derrame pleural es una manifestación poco frecuente y representa solo el 10% de los casos. [10] Algunos pacientes debutan con síndromes paraneoplásicos. La hipoglucemia persistente, se describe en el 4,5% de los portadores de TFSP y podría estar relacionada con la producción de un factor de crecimiento similar a la insulina secretado por el tumor, entidad denominada como síndrome de Doege-Potter. [10] En nuestro caso, la hipoglucemia se hizo La TAC es el método propuesto para la evaluación preoperatoria de los TFSP. [1] Sin embargo, cuando es necesario determinar el compromiso de la columna vertebral o las raíces nerviosas en tumores de localización posterior, la RMN puede jugar un rol importante en su evaluación. [3] El tumor puede infiltrar el parénquima pulmonar o las estructuras mediastinales, hecho que es más frecuente en la variante maligna. En éstos casos parece atractivo el uso de tomografía por emisión de positrones (PET - scan), para evaluar el compromiso sistémico de la enfermedad, sin embargo, Lahon et al. [3], en una serie de 157 pacientes, sólo realizaron PET-scan en 7 de ellos, con imágenes sugestivas de malignidad en la TAC. En su publicación concluyeron que la PET – scan, no aportaría mayores datos que la TAC en el diagnóstico preoperatorio de estos pacientes evidente durante los últimos meses previos a la consulta.
La osteoartropatía hipertrófica pulmonar, caracterizada por hipoxia crónica y manifestaciones osteoarticulares secundarias, es otra forma de presentación y simula un cuadro de suedoartritis. Además, se pueden observar acropaquias en forma de dedos en palillos de tambor. [1,2] Las biopsias por punción con aguja fina o con aguja gruesa, no son métodos sensibles, presentando altas tasas de falsos negativos. [1,2] La punción biopsia estaría reservada para los casos de pacientes sin chances quirúrgicas o con elevado riesgo para el procedimiento. [3] La histología muestra células similares a fibroblastos, con distribución estoriforme y un estroma con abundante fibras colágenas, con escasa actividad mitótica. [1] El estudio inmunohistoquímico es necesario para el diagnóstico diferencial. Los TFSP son generalmente vimentina (+), CD34 (+), bcl-2 (+), CD99 (+) y son negativos para S-100 y PANK. England et al.[11], determinaron criterios de malignidad clásicos que consisten en: hipercelularidad, pleomorfismo nuclear, la presencia de más de 4 figuras mitóticas por 10 campos de gran aumento, invasión vascular, atipia celular y necrosis. En nuestro caso, la anatomía patológica solo demostró hipecelularidad. Aún así, los criterios propuestos por England no son útiles para predecir la sobrevida de los pacientes.
La resección se recomienda en todos los casos, por la dificultad del diagnóstico preoperatorio y la incertidumbre en cuanto a su comportamiento maligno. [1,12] Además, porque como se pudo evidenciar en este caso, el crecimiento del tumor puede ser excesivo, aumentando el riesgo quirúrgico y la morbimortalidad postoperatoria innecesariamente.
El abordaje se realiza por toracotomía o por videotoracoscopía y la elección de la técnica dependerá del tamaño de la lesión. [1,6] Aquellas lesiones menores a 6 centímetros son pasibles de ser tratadas mediante videotoracoscopía. Las masas entre 6 – 10 cm requieren una toracotomía mínima para la extracción del material. Los tumores mayores de 10 cm, se deben resecar mediante una toracotomía amplia [6,13] y aquellos con patrón “invertido” (crecimiento hacia el parénquima pulmonar) pueden requerir incluso la resección de un lóbulo pulmonar. [1] Es de suma importancia realizar todos los métodos complementarios necesarios para determinar la resecabilidad del tumor. Se debe, además, tomar las precauciones necesarias (ej. pericardio bovino, malla de marlex y prótesis vasculares) para el reemplazo o la plástica de estructura durante la cirugía.
La recurrencia oscila entre el 2 % y el 63% dependiendo de la histología del tumor y se han descripto recidivas hasta 25 años posteriores a la resección. [1,4] Según Lahon et al [3], las esecciones mayores, los tumores sésiles y aquellos con marcación negativa para CD34, son factores de riesgo estadísticamente significativos para la recurrencia, e imlican, la necesidad de tratamiento adyuvante postquirúrgico a base de quimioterapia asociada o no a radioterapia.
Bibliografía
1. Ferreira BEJ, Díaz PJA. Tumor fibroso solitario de pleura. Rev Chilena de Cirugía 60(5): 465-472, 2008. 28-314. Robinson L A. Solitary Fibrous Tumor of the Pleura. Cancer Control 13(4): 264-269, 2006.
5. Briselli M, Mark EJ, Dickersin GR. Solitary fibrous tumors of the pleura: eight new cases and review of 360 cases in the literature. Cancer 47: 2678-2689, 1981.
6. Takahama M, Kushibe K, Kawaguchi T, Kimura M, Taniguchi Sh. Video-Assisted Thoracoscopic Surgery Is a Promising Treatment for Solitary Fibrous Tumor of the Pleura. Chest 125: 1144-1147, 2004.
7. Tanaka M, Sawai H, Okada Y et al. Malignant solitary fibrous tumor originating from the peritoneum and review of the literatura. Med Sci Monit 12: 95-98, 2006.
8. Atavilla G, Blandamura S, Gardiman M, Salmaso R, Piazza M.Solitary fibrous tumor of the pericardium. Phatologica 87: 82-86, 1995.
9. Falconeri G, Lamovec J, Mirra M, Pizzolito S. Solitary fibrous tumor of the mammary gland: a potential pitfall in breast pathology. Ann Diagn Pathol 8: 121-125, 2004.
10. Moreno Mata N, Gonzalez Aragoneses F, Vazquez Pelillo JC, Peña Gonzalez E, Orusco E, Folqué Gomez E. Hipoglucemias severas secundarias a tumor fibroso pleural. Ann Med Int 14: 579-582, 1997.
11. England DM, Hochholzer L, McCarthy MJ. Localized bening and Malignant fibrous tumors of the pleura. A clinicophatologic review of 223 cases. Am J Surg Pathol 13: 640-658, 1989.
12. De Perrot H. Solitary Fibrous Tumor of the Pleura. Ann Thorac Surg 74: 285-293, 002.
13. Galbis Caravajal JM, Sales Badía JG, Navarro Hervás M, et al. Tumores fibrosos de localización pleural: valoración clinicoquirúrgica. Arch Bronconeumol 40(9): 419-421, 2004.