Volumen 35, Nº 1 | 2017
Actualización de infección por Clostridium difficile - Clostridium difficile infection update
Juan Pablo Caeiro, María Isabel Garzón
Palabras clave: Clostridium difficile, diarrea, antibióticos, infección asociada al cuidado de la salud.
Keywords: Clostridium difficile, diarrhea, antibiotics, infection related to health care.
INTRODUCCIÓN
En 1893 Finney y Osler describieron el primer caso de enterocolitis pseudomembranosa. El nombre de la bacteria Bacillus difficilis surge en 1935 por Hall-O’Toole. En 1974 Tedesco y colaboradores, sugieren la asociación entre clindamicina y colitis pseudomembranosa. Finalmente en 1978 se identifica al Clostridium difficile como causante de colitis pseudomembranosa.
Clostridium difficile (CD) es un bacilo gram-positivo,anaerobio estricto, capaz de formar esporas que permiten una fácil diseminación en el medio hospitalario, como así también su supervivencia en el tiempo. Su transmisión es por vía fecal–oral lo que convierte al personal de la salud y al instrumental médico en una importante fuente de infección intrahospitalaria. Se lo considera el principal agente causal de diarrea nosocomial asociada principalmente al tratamiento con antibióticos. Pero también se lo ha encontrado en el ganado, comidas y el ambiente.
La enfermedad que produce se denomina infección por Clostridium difficile (ICD). Esta bacteria, a nivel del colon, produce toxina A o enterotoxina y toxina B o citotoxina. Ambas tienen efecto citotóxico, causando permeabilidad vascular y hemorragia, pero además, la enterotoxina induce la acumulación de líquidos y células inflamatorias, mientras que la citotoxina causa destrucción del citoesqueleto del enterocito, siendo más potente que la primera.
Todas las cepas de CD toxigénicas presentan un locus de patogenicidad (PaLoc) de 19,6 kb. Este locus está formado por 5 genes (tcdA, tcdB, tcdC, tcdE y tcdR). Los genes tcdA y tcdB codifican dos toxinas A y B respectivamente, ambas responsables de la patogenicidad de CD. El gen tcdR actúa como regulador positivo de la expresión de tcdA y tcdB, mientras que tcdC actúa como regulador negativo. Los genes tcdA, tcdB y tcdR se transcriben durante la fase de crecimiento estacionaria, mientras que tcdC se expresa ya en la fase de crecimiento exponencial.
La morbilidad y mortalidad parecen estar en aumento probablemente por aparición de cepas hipervirulentas que producen más toxina que las otras cepas.
La infección por Clostridium difficile (ICD) se define como >3 heces no formadas/24 horas, ya sea líquidas o blandas, asociada a detección de toxina A y/o B del Clostridium.
EPIDEMIOLOGÍA
ICD ocurre en 7 casos/10.000 pacientes con un día de estadía hospitalaria en Europa (1). La tasa de incidencia de infección por Clostridium difficle en Argentina fue 3,1/1000 paciente día y 1,1/1000 paciente días durante 30 días de seguimiento (2). En Estados Unidos la ICD ocurre a una tasa de 150 casos/100.000 personas/año (CDC anual report 2015). Existen >500.000 pacientes infectados/año en Estados Unidos con 14.000 muertes anuales relacionadas (3). La incidencia de ICD aumenta con estadías hospitalarias más largas.
Los factores de riesgo más importantes son la edad del paciente, la exposición a antibióticos, la presencia de comorbilidades e inmunosupresión. Se describe predisposición genética en polimorfismo del gen promotor de IL-8 (4).
MECANISMO
La cepas de Clostridium difficile se clasifican por RFLP (PCR-restriction fragment length polymorphism) en 34 toxinotipos según cambios en el locus de patogenicida de PaLoc (5). Debemos conocer la cepa hipervirulenta de Clostridium difficile, 027/NAP/BI con deleción del nucleótido 117 en tcdC. La cepa produce 16 veces más toxina A y 23 veces más toxina B que la cepa habitual. También tiene mayor esporulación y es resistente a fluoroquinolonas (6). Es importante conocer que cepas existen en distintos lugares para evaluar nuevos métodos diagnósticos, factores epidemiológicos y una futura vacuna.
Aunque el secuenciamiento del genoma completo parece ser el método molecular más preciso para evaluación epidemiológica todavía faltan estudios para demostrar su utilidad global (7).
CUADRO CLÍNICO
La presentación clínica puede variar desde pacientes asintomáticos o con diarrea leve no complicada, hasta a una infección grave potencialmente mortal. Esta variabilidad, en su presentación clínica y curso de enfermedad, está relacionada con las características del huésped y la cantidad de inoculo. La descripción clásica de colitis pseudomembranosa en colonoscopía no es exclusiva de esta infección (colitis por anti-inflamatorios, por Escherichia coli enterohemorrágica, otras bacterias y colitis isquémica) (8).
La diarrea por CD es habitualmente líquida y abundante, puede asociarse a la evacuación de mucus o sangre oculta, como así también se puede acompañar de fiebre, leucocitosis y dolores abdominales. Las manifestaciones extra intestinales, como la bacteriemia y la artritis son poco frecuentes (9). Los pacientes con enfermedad severa pueden desarrollar un íleo del colon y una dilatación tóxica, acompañada de mínima o nula diarrea. Las complicaciones de colitis severa por C. diffi cile incluyen deshidratación, trastorno en los electrolitos, hipoalbuminemia, megacolon tóxico, perforación intestinal, hipotensión, insufi ciencia renal, síndrome de respuesta infl amatoria sistémica, sepsis y muerte.
DIAGNÓSTICO
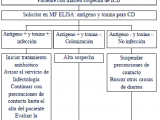
El diagnóstico de infección por Clostridium difficile es complejo porque implica la sintomatología gastrointestinal y la detección de las toxinas involucradas en la enfermedad. Se considera “gold standard” para el diagnóstico de infección al ensayo citotóxico celular y el cultivo citotóxico (10). El problema de estas pruebas diagnósticas es la necesidad de entrenamiento para realizarlas y el tiempo que insumen en el resultado (2 a 5 días). Por lo tanto, actualmente se utilizan distintos algoritmos diagnósticos según la disponibilidad de cada centro. En nuestro medio recomendamos el siguiente algoritmo (Fig. 1). Solo se sugiere procesar heces diarreicas y no las heces sólidas. La única excepción para testear heces no diarreicas sería en presencia de íleo.
TERAPIA
Las dos drogas disponibles en Argentina para tratar ICD son la vancomicina y metronidazol. En otros países se agrega una tercera droga que es la fidaxomicina. La vancomicina es superior al metronidazol en la infección intestinal. La superioridad de vancomicina sobre metronidazol fue confirmada en estudios randomizados que compararon tolevamer, metronidazol y vancomicina (11). Se debe discontinuar la terapia antimicrobiana inicial lo más pronto posible. Esto disminuye el riesgo de recurrencia de ICD como así también evitar el uso de agentes antiperistálticos.
Se recomienda como terapia en el primer episodio, metronidazol 500 mg cada 8 horas por vía oral por 10-14 días. En el caso de una presentación severa, se recomienda como terapia inicial vancomicina oral 125 mg cada 6 horas por 10-14 días. En la primera recurrencia se recomienda el mismo esquema del primer episodio y en la segunda recurrencia o tardía vancomicina oral 125 mg cada 6 hs. La dosis de vancomincina en casos severos es de 500 mg cada 6 horas por vía oral, enteral o rectal.
RECURRENCIA
Los factores de riesgo más importante para la recurrencia son edad de >65 años y el uso continuo de antibióticos. Existen otros factores como el uso de inhibidores de la bomba de protones, enfermedad inflamatoria intestinal y comorbilidades. Se intentan hacer puntajes de predicción de recurrencias pero es compleja su validación en centros de salud. Lo interesante sería predecir quien va a tener recurrencia y actuar anticipadamente (12).
FIDAXOMICINA
Es el antibiótico más nuevo desarrollado para tratar ICD. Presenta varias ventajas sobre las otras terapias. Para tratar el primer episodio de infección es igualmente efectivo que vancomicina pero con menor frecuencia de recurrencia. Afecta mínimamente la microbiota intestinal. A pesar de ser una medicación de alto coste ha demostrado costo-efectividad en estudios recientes (13).
TRANSPLANTE DE MATERIA FECAL O MICROBIOTA
La infección por Clostridium difficile puede recurrir en un 25% de los casos. Existen pacientes con varias recurrencias difíciles de tratar. La disbiosis intestinal producida por antibióticos se restablece con el trasplante de materia fecal o de microbiota intestinal. La eficacia de esta terapéutica ha sido establecida aunque el procedimiento es engorroso. Se instila un filtrado de heces de una persona sana previamente estudiado para descartar infecciones transmisibles. Se administra por sonda nasogástrica o por vía rectal por colonoscopía (14).
USO DE AGENTES ANTIMOTILIDAD INTESTINAL (ESTUDIO DE NARCÓTICOS)
Un estudio reciente demostró que el uso moderado a elevado de analgésicos narcóticos aumentaba el riesgo de adquirir ICD (15). Se recomienda no usar o moderar el uso de agentes antimotilidad con actividad opiácea cuando exista diagnóstico de la infección.
CIRUGÍA
Se debe considerar cirugía cuando se presenta megacolon tóxico severo, perforación intestinal o empeoramiento del cuadro clínico a pesar del tratamiento médico. La cirugía puede ser colectomía subtotal con mantenimiento del recto e ileostomía terminal. Otra opción sería ileostomía en asa derivativa (16).
PREVENCIÓN (PRECAUCIONES DE CONTACTO)
El principal modo de contagio de CD es de una persona a otra a través de la vía fecal-oral, principalmente dentro de las instalaciones hospitalarias con pacientes internados. La contaminación ambiental y la incorrecta higiene de los espacios hospitalarios o relacionados al cuidado de la salud también tienen un papel importante en la transmisión de CD en entornos de la atención médica. Por esto es necesario el aislamiento del paciente en habitación individual, minimizar el número de visitas y utilizarprotección personal con uso de bata y guantes en todo personal que atienda al paciente. Del mismo modo, la limpieza de la habitación se recomienda realizar con agua y lavandina (por lo menos 5000 ppm de cloro). Estas precauciones y limpieza deben continuarse hasta el alta del paciente. Se recomienda realizar higiene de manos con agua y jabón para eliminar las esporas. El alcohol en gel no sería efectivo para ICD. Es importante tener en cuenta que los portadores asintomáticos puede transmitir Clostridium difficile a pacientes hospitalizados (17).
PREVENCIÓN DE LA INFECCIÓN MIENTRAS SE RECIBE ANTIBIÓTICOS
Es un problema para el médico saber qué hacer en pacientes con infección por Clostridium difficile y otra infección concomitante. Un estudio retrospectivo mostró que vancomicina oral disminuía la recurrencia comparada con no recibir otra profilaxis (18).
ANTICUERPOS MONOCLONALES
Bezlotozumab es un anticuerpo monoclonal humano de IgG1 que se une y neutraliza la toxina B del Clostridium difficile (se administra en única infusión). Bezlotozumab disminuyó un 40% la recurrencia comparado con placebo. Ha sido aprobado por la FDA para prevenir recurrencias de ICD en pacientes en riesgo alto.
CONCLUSIÓN
La ICD es una causa importante de diarrea en los hospitales e instituciones relacionadas con el cuidado de la salud. La principal prevención para esta infección es el uso controlado de antibióticos, la adecuada descontaminación ambiental, como así también minimizar el tiempo de internación del paciente.
Bibliografía
1. Davies KA, Longsahw CM, Davis GL, Bouza E, Barbut F, Barna Z, et al. Underdiagnosis of Clostridium difficile across Europe: the European, multicentre, prospective, biannual, point-prevalence study of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID). Lancet Infect Dis 2014; 14: 1208-1219.2. Lopardo G, Morfin-Otero R, Moran-Vazquez II. Epidemiology of Clostridium difficile: a hospital-based descriptive study in Argentina and Mexico. Braz J Infect Dis 2015; 19: 8-14.
3. F.C. Lessa, Y. Mu,W.M. Bamberg, et al., Burden of Clostridium difficile infection in the United States, N. Engl. J. Med. 2015; 372: 825-834.
4. DuPont HL, Garey K, Caeiro JP, Jiang ZD. New advances in Clostridium difficile infection: changing epidemiology, diagnosis, treatment and control. Curr Opin Infect Dis 2008; 21:500-507.
5. Rupnik M, Janezic S. An update on Clostridium difficile toxinotyping. J Clin Microbiol 2016; 54:13–18.
6. Thompson A, Brazier J, et al. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005; 366:1079-84.
7. Gerding DN. Whole-genome sequencing of Clostridium difficile: Exquisitely sensitive but not yet optimally applied. Clin Infect Dis 2016; 62: 753-4.
8. Tang D. M., Urrunaga N. H., Von Rosenvinge E. C. Pseudomembranous colitis: Not always Clostridium difficile. Cleve Clin J Med.2016; 83:361-366.
9. Bouza E., Gonzalez Del Vecchio M., Reigadas E. Spectrum of Clostridium difficile infections: Particular clinical situations. Anaerobe 2016; 37:3-7.
10. Chen S, Gu H, Sun C, Wang H, Wang J.Rapid detection of Clostridium difficile toxins and laboratory diagnosis of Clostridium difficile infections. Infection. 2017;45:255-262 .
11. Johnson S, Louie TJ, Gerding DN, Cornely OA, Chasan-Taber S, Fitts D, et al. Vancomycin, Metronidazole, or Tolevamer for Clostridium difficile Infection: Results from two multinational, randomized, controlled trials. Clin Infect Dis 2014; 59:345–54.
12. Carpenter B.P., Hennessey E.K., Bryant A. M., et al. Identification of Factors Impacting Recurrent Clostridium difficile Infection and Development of a Risk Evaluation Tool. J Pharm Pharm Sci 2016; 19: 349 – 356.
13. Watt M, Dinh A, Le Monnier A, Tilleul P. Cost-effectiveness analysis on the use of fidaxomicin and vancomycin to treat Clostridium difficile infection in France. J Med Econ. 2017;20:678-686.
14. Kelly CR, Khoruts A, Staley C, Sadowsky MJ, Abd M, Alani M, et al. Effect of fecal microbiota transplantation on recurrence in multiply recurrent Clostridium difficile infection. Ann Intern Med 2016;165:609-616.
15. Mora AL, Salazar M, Caeiro JP, Frost CO, Yadav Y, DuPont HL, et al. Moderateto High Use of Opioid Analgesics Are Associated with an Increased Risk of Clostridium difficile Infection. Am J Med Sci 2012; 343:277–280.
16. Neal MD, Alverdy JC, Hall DE, Simmons RL, Zuckerbraun BS. Diverting loop ileostomy and colonic lavage: an alternative to total abdominal colectomy for the treatment of severe, complicated Clostridium difficile associated disease. Ann Surg. 2011; 254:423–7.
17. Fehér C., Mensa J. A comparison of current guidelines of five international societies on Clostridium difficile infection management. Infect Dis Ther 2016; 5: 207-230.
18. Van Hise NW, Bryant AM, Hennessey EK. Efficacy of Oral Vancomycin in Preventing Recurrent Clostridium difficile Infection in Patients Treated with Systemic Antimicrobial Agents. Clin Infect Dis. 2016; 63:651-3.