Volumen 34, Nº 2 | 2016
KRAS en cáncer colorrectal: características clínico-patológicas y sobrevida global. Experiencia Institucional - KRAS in colorectal cancer: clinical pathological features and overall survival. Institutional experience
Jeremías Tomás Sierra, Juliana Mandrile, Rodolfo Agustín Avila, Virginia Soledad Miretti, Leandro Roberto Castellanos, Andrea Gabriela Soria, Juan José García
Palabras clave: Cáncer colorrectal, KRAS; Cetuximab
Keywords: colerectal cancer, KRAS, cetuximab
Introducción
La incidencia esperada del cáncer colorrectal para el año 2015 en Argentina, fue de 14295 nuevos casos según lo estimado por la International Agency Research on Cancer (IARC), siendo esta enfermedad la tercera causa de muerte por cáncer en nuestro país (1).
En los últimos años se han descubierto nuevos genes involucrados en la carcinogénesis y sus productos, permitiendo de esta forma crear terapias dirigidas frente a blancos moleculares con intento de combatir el cáncer. El oncogen RAS es un controlador de funciones celulares como proliferación, apoptosis y diferenciación celular entre otras, por lo que su mutación tiene implicancias predictivas en neoplasias malignas de diferente localización anatómica, incluyendo al cáncer colorrectal (2).
Analizamos las características clínicas y patológicas de los pacientes con cáncer colorrectal metastásico de nuestra institución y su sobrevida de acuerdo al estado del KRAS.
Materiales y métodos
Estudio retrospectivo que incluyó 82 pacientes con cáncer colorrectal metastásico y estado de KRAS conocido, entre el año 2009 y 2015.
Se obtuvieron de sus historias clínicas las características como edad, sexo, localización anatómica, histología y sitio de metástasis. Además, se calculó la sobrevida global (SG) en relación al estado del Kirsten Rat Sarcoma Virus (KRAS), la resección completa de las metástasis, y a la incorporación de cetuximab en el tratamiento de pacientes con KRAS no mutado (WT: wilde type)
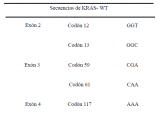
El material fue procesado en laboratorios de referencia donde a partir de biopsias en parafina, se extrajo el ADN de células tumorales y se amplificó mediante la técnica de reacción en cadena de polimerasa (PCR) con primers específicos para codones 12 y 13 (exón 2), 59 y 61 (exón 3), 117 y 146 (exón 4). Posteriormente se purificaron, secuenciaron y analizaron los productos de amplificación (Tabla 1).
Para el análisis de variables no paramétricas y paramétricas se utilizaron los test de Chi cuadrado y el t-test. La valoración de la SG se realizó mediante el método de curvas de supervivencia de Kaplan- Meier.
Resultados
De los 82 pacientes incluidos, 45 (54,9%) fueron hombres y la media para la edad de acuerdo al sexo fue de 59,8 (52,9-66,7) años y 52,3 (40-64,6) años para hombres y mujeres respectivamente.
Cincuenta (60,9%) pacientes tenían metástasis al diagnóstico y 32 las desarrollaron posteriormente.
En todos los pacientes se secuenció el exón 2 (codones 12 y 13); mientras que los exones 3 (codones 59 y 61), y exón 4 (codones 117 y 146) se estudiaron solo en el 18,3 % de los pacientes. Se encontró un total de 36 (43.9%) de KRAS mutados.
De estas 36 mutaciones las más frecuentes fueron la del exón 2 codón 12 (29), seguida por mutaciones concomitante del codón 12 y 13 (5), mutación del codón 13 (2) y una sola mutación del exón 4 (80,56%, 13,88% y 5,55% respectivamente). Las características clínicas y patológicas se detallan en la Tabla 2.
Un total de 74 pacientes (92,68%) tuvieron histología de adenocarcinoma invasor, 6 (7,31%) de adenocarcinoma mucinoso y 2 (2,43%) de adenocarcinoma en células en anillo de sello.
No se encontró asociación entre el estado del KRAS y el subtipo histológico, la edad del paciente ni el sitio de localización del tumor primario. No hubo asociación con la presencia de metástasis pulmonares en ausencia de metástasis hepáticas.
Los esquemas de tratamiento más utilizados en primera línea fueron combinaciones de fluoropirimidinas (capecitabina o 5FU) con oxaliplatino (FOLFOX 51,2%, XELOX 18,3%) o irinotecan (FOLFIRI 13,4%). Las fluoropirimidinas solas se utilizaron en el 9,8% de los pacientes. Un 7,3% de los pacientes recibieron quimioterapia de conversión con FOLFOXIRI. Asociado a los esquemas anteriores se indicó bevacizumab en primera línea en el 22% de los pacientes.
De los 46 pacientes con KRAS-WT, 20 recibieron cetuximab: 6 lo hicieron en 1ra línea, 8 en 2da y 6 en 3ra línea.
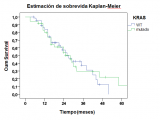
El análisis de la sobrevida global media fue de 32,7 meses, y no se demostró diferencia estadísticamente significativa entre pacientes con KRAS-WT y pacientes con KRAS mutado (28,9 meses vs. 35,8 meses p= 0.77) (Fig 1), tampoco hubo diferencias entre los pacientes con KRAS-WT tratados con cetuximab (28,3 meses) en comparación con los que no lo hicieron (30,4meses P= 0,8) (Fig 2).
Por último, solo encontramos una diferencia significativa en sobrevida global en aquellos pacientes en que además del tratamiento con quimioterapia estándar (QT) se logró una resección completa (R0) del tumor primario y de sus metástasis [OSm de 24,8 meses (QT) vs. 48 meses (QT+R0) P=0.001]. (Fig 3)
Discusión
KRAS es una proteína G de membrana asociada al receptor del factor crecimiento epidérmico (EGFR) y cuya función es la traducción de señales intracelulares. La presencia del KRAS mutado, origina una activación permanente de esta proteína G y de las vías de señalización, lo que ha sido implicado en el mantenimiento y crecimiento de tumores (3). Posteriormente se descubrió que las tres isoformas del oncogen RAS: KRAS, NRAS, y en menor frecuencia HRAS, también están implicadas en este mecanismo fisiopatogénico.
Numerosos estudios describen la prevalencia de las mutaciones de este oncogen y recientemente Peeters M y cols publicaron una prevalencia del 55,9% de mutaciones del RAS en el cáncer colorrectal (KRAS 52,6% y NRAS 7,4%) (4).
Los estudios son discrepantes en cuanto a la asociación de las mutaciones de KRAS con la edad y sexo de los pacientes (5,6). También lo son con la localización anatómica del tumor, existiendo reportes de mayor frecuencia de mutaciones en el colon derecho, y otros en el colon izquierdo (7,8,9). En el presente estudio no hemos hallado asociación con ninguno de estos factores.
Por otro lado, varios autores han demostrado relación entre los subtipos histológicos y la frecuencia de mutaciones del KRAS, pudiendo existir una mayor prevalencia de éstas en los adenocarcinomas de colon con diferenciación mucinosa (9,10). A pesar de esto, no pudimos demostrar esta asociación en los pacientes estudiados.
El hígado y en segundo lugar el pulmón son los órganos más afectados por el cáncer colorrectal. Existen patrones de diseminación metastásica donde su afectación inicial es pulmonar sin afectación hepática. Algunos han encontrado una incidencia mayor de este fenómeno en tumores con KRAS mutado comparado con KRAS WT (11,12). Esta relación no ha sido demostrada en este análisis.
En las últimas décadas, se ha comprobado que el estado del KRAS es un factor pronóstico y predictivo. Su impacto sobre la sobrevida libre de progresión y global ha sido publicado en el estudio multicéntrico RASCAL, el cual incluyó un análisis de 3439 pacientes, demostrando que los tumores con mutación del KRAS en el codón 12 presentaban mayor agresividad con una sobrevida significativamente menor (13).
Por otro lado, el KRAS predice la respuesta a anticuerpos monoclonales contra EGFR como cetuximab y panitumumab, logrando mayor sobrevida aquellos pacientes que poseen tumores colorrectales con KRAS-WT (14-17).
En el estudio multicéntrico fase III Crystal, se obtuvieron beneficios significativos con el agregado de cetuximab al tratamiento con FOLFIRI en primera (sobrevida media libre de progresión 9,9 vs 8,4 meses; HR 0.696 P=0012, sobrevida global 23,5 vs. 20,0 meses; hazard ratio [HR] 0.796; P=0093) (14-15). Similares beneficios han demostrado la utilización de cetuximab o panitumomab en combinación con quimioterapia basada en oxaliplatino (16-17).
Actualmente con la utilización de quimioterapia combinada con biológicos, la sobrevida global media de pacientes con cáncer colorrectal metastásico es de aproximadamente 30 meses (18). En pacientes seleccionados, la resección de metástasis hepáticas o pulmonares mediante cirugía y/o técnicas ablativas como radiofrecuencia, junto con la extirpación del tumor primario, logra resultados superiores en sobrevida global a 5 años (27 al 68%), con una baja morbi-mortalidad (19-22. Este beneficio, fue evidente en nuestro estudio, al demostrar la duplicación de la sobrevida media en pacientes con resección completa de la enfermedad.
Conclusión
No se encontró asociación entre el estado del KRAS y las características clínico-patológicas. La sobrevida global media de nuestra población fue ligeramente mayor a la conocida en la actualidad con la combinación de quimioterapia y biológicos, pero al realizar el análisis comparativo entre los pacientes sometidos a resección completa del tumor primario y sus metástasis frente a los que no, los resultados se asemejaron a los de las publicaciones actuales, encontrando un claro beneficio de la resección de las metástasis hepáticas. Por otro lado, es probable que el número de pacientes estudiados no sea el suficiente para encontrar una diferencia significativa en la SG de acuerdo con el estado del KRAS o con el tratamiento con cetuximab.
Bibliografía
1. Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet].2. Arrington AK, Heinrich EL, Lee W, Duldulao M, Patel S, Sanchez J. Prognostic and predictive roles of KRAS mutation in colorectal cancer. Int J Mol Sci. 2012; 13:12153-68
3. Tan C, Du X. KRAS mutation testing in metastatic colorectal cancer. World J Gastroenterol. 2012;18:5171-80.
4. Peeters M, Kafatos G2, Taylor A, Gastanaga VM, Oliner KS, Hechmati G, Terwey JH. Prevalence of RAS mutations and individual variation patterns among patients with metastatic colorectal cancer: A pooled analysis of randomised controlled trials. Eur J Cancer. 2015;51:1704-13.
5. Breivik J, Meling GI, Spurkland A, Rognum TO, Gaudernack, et al. G. K-ras mutation in colorectal cancer: relations to patient age, sex and tumour location. Br J Cancer. 1994; 69:367-371.
6. Gil Ferreira C, Aran V, Zalcberg-Renault I, Victorino AP, Salem JH, Bonamino MH. KRAS mutations: variable incidences in a Brazilian cohort of 8,234 metastatic colorectal cancer patients. BMC Gastroenterol. 2014;14:73.
7. Bleeker WA1, Hayes VM, Karrenbeld A, Hofstra RM, Hermans J, Buys CC, Plukker JT, et al ..Impact of KRAS and TP53 mutations on survival in patients with left- and right-sided Dukes' C colon cancer. Am J Gastroenterol. 2000;95:2953-7.
8- Zulhabri O, Rahman J, Ismail S, Isa MR, Wan Zurinah WN.. Predominance of G to A codon 12 mutation K-ras gene in Dukes' B colorectal cancer. Singapore Med J. 2012;53:26-31.
9- Rosty C, Young JP, Walsh MD, Clendenning M, Walters RJ, Pearson S, et al. Colorectal carcinomas with KRAS mutation are associated with distinctive morphological and molecular features. Mod Pathol. 2013;26:825-34.
10- Lin JK, Chang SC, Wang HS, Yang SH, Jiang JK, Chen WC, et al. Distinctive clinicopathological features of Ki-ras mutated colorectal cancers. J Surg Oncol. 2006;94:234-41.
11- Talha B, Abdelsalam I. Higher prevalence of KRAS mutations in colorectal cancer in Saudi Arabia: Propensity for lung metastasis. Alejandría Journal of Medicine 2014;50,203-09.
12- Tie J1, Lipton L, Desai J, Gibbs P, Jorissen RN, Christie M, et al. KRAS Mutation Is Associated with Lung Metastasis in Patients with Curatively Resected Colorectal Cancer. Clin Cancer Res. 2011;17:1122-30.
13. Andreyev HJ, Norman AR, Cunningham D, Oates J, Dix BR, Iacopetta BJ, et al. Kirsten ras utations in patients with colorectal cancer: the 'RASCAL II' study. Br J Cancer. 2001;85:692-6
14. Van Cutsem E, Köhne CH, Hitre E, Zaluski J, Chang Chien CR, Makhson A, et al. Cetuximab and Chemotherapy as Initial Treatment for Metastatic Colorectal Cancer. N Engl J Med. 2009;360:1408-17.
15. Van Cutsem E, Köhne CH, Láng I, Folprecht G, Nowacki MP, Cascinu S, et al. Cetuximab Plus Irinotecan, Fluorouracil, and Leucovorin As First-Line Treatment for Metastatic Colorectal Cancer: Updated Analysis of Overall Survival According to Tumor KRAS and BRAF Mutation Status. JCO 2011; 29:2011-19
16. Tabernero J, Van Cutsem E, Díaz-Rubio E, Cervantes A, Humblet Y, André T, et al. Phase II Trial of Cetuximab in Combination With Fluorouracil, Leucovorin, and Oxaliplatin in the First-Line Treatment of Metastatic Colorectal Cancer . J Clin Oncol. 2007; 25:5225-32
17. Douillard JY, Siena S, Cassidy J, Tabernero J, Burkes R, Barugel M, et al. Randomized, Phase III Trial of Panitumumab With Infusional Fluorouracil, Leucovorin, and Oxaliplatin (FOLFOX4) Versus FOLFOX4 Alone As First-Line Treatment in Patients With Previously Untreated Metastatic Colorectal Cancer: The PRIME Study. J Clin Oncol. 2010;28:4697-705.
18. Elez E, Argilés G, Tabernero J. First-Line Treatment of Metastatic Colorectal Cancer: Interpreting FIRE-3, PEAK, and CALGB/SWOG 80405. Curr Treat Options Oncol. 2015;16:52
19. Gonzalez M, Poncet , Combescure C, Robert J, Ris HB, Gervaz P. Risk factors for survival after lung metastasectomy in colorectal cancer patients: a systematic review and meta-analysis. Ann Surg Oncol. 2013;20:572-9.
20. Wei A, Greig P, Grant D, Taylor B, Langer B, Gallinger S. Survival after hepatic resection for colorectal metastases: a 10-year experience. Ann Surg Oncol. 2006; 13:668.
21. Rees M, Tekkis P, Welsh FK, O’Rourke T, John TG. Evaluation of long-term survival after hepatic resection for metastatic colorectal cancer: a multifactorial model of 929 patients. Ann Surg. 2008; 247:125-35.
22. Ruers T, J. Punt C, van Coevorden F et al. Radiofrequency ablation (RFA) combined with chemotherapy for unresectable colorectal liver metastases (CRC LM): Long-term survival results of a randomized phase II study of the EORTC-NCRI CCSG-ALM Intergroup 40004 (CLOCC). J Clin Oncol 33. 2015 (suppl; abstr 3501).