Volumen 34, Nº 1 | 2016
Pólipos serrados - Serrated polyps
Fernando Andrés Diehl, Andrea Bolomo, Yanina Carlino, Cecilia Quintana Lazópulos, Emilia García Chiple, Mariano Antonio Higa, Silvia Bertola, Domingo Balderramo
Palabras clave: pólipo serrado, colonoscopía, cáncer colorrectal
Keywords: serrated polyps, colonoscopy, colorectal cancer
El cáncer colorrectal (CCR) constituye en la actualidad la segunda neoplasia de mayor incidencia en Argentina teniendo en cuenta ambos sexos, y ocupa el segundo lugar en mortalidad por cáncer luego del cáncer de pulmón (1).
Durante las últimas tres décadas, mucho se ha estudiado sobre la fisiopatología, oncogenética e historia natural del CCR. En la mayoría de los casos de CCR, una lesión premaligna llamada adenoma, sufre una serie de eventos citogenéticos (“vía tradicional” de la carcinogénesis), asociada a la inestabilidad cromosómica e iniciada mediante inactivación de genes de reparación de ADN como el APC (2). Sin embargo, sólo el 70-80% de los adenocarcinomas de colon presentan este tipo de comportamiento, existiendo hasta un 30% de los casos que no siguen la vía “adenoma-carcinoma” tradicional, generándose por vías de carcinogénesis alternativas (3-5). Esta cascada de eventos moleculares, llamada “vía serrada” de carcinogénesis era desconocida hasta hace pocos años y daría lugar a la aparición de lesiones premalignas llamadas pólipos serrados (PS). Se cree que el mecanismo de origen de malignidad en éste tipo de carcinomas se originaría a partir de una mutación de 2 tipos de oncogenes distintos llamados k-ras y BRAF (6). Los PS tienen características morfológicas, endoscópicas y anatomopatológicas diferentes a los adenomas tradicionales, y más importante aún, se cree que tienen comportamiento clínico diferente a los adenomas. Tal es así, que se ha vinculado a los CCR de intervalo con los PS y se los ha asociado a un mayor riesgo de CCR metacrónico y sincrónico, por lo que se deduce que requieren de menor tiempo para malignizarse que los adenomas (2). Dentro de sus características, el tamaño mayor a 10 mm de diámetro, la localización proximal, la multiplicidad y la presencia de displasia son los factores que más se han asociado a malignización. En Argentina existen pocos estudios sobre el tema. Un estudio de Fischer y cols estimó la prevalencia de los pólipos serrados en 0,87% (7).
En el presente artículo se realizará una revisión sobre definiciones, implicancias clínicas y manejo de los PS.
Definiciones
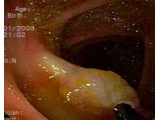
Los PS son un grupo heterogéneo de lesiones mucosas colónicas con una característica común: histológicamente, su arquitectura recuerda los dientes de una sierra, pudiendo presentar o no displasia (Fig.1) (8). Esta morfología “aserrada” sería el resultado de un aumento del recambio celular del epitelio de las criptas asociado a una disminución de la apoptosis celular y fallo en la migración celular, llevando a que la superficie de la cripta se pliegue sobre sí misma adoptando la forma de dientes de sierra (9). Existen subtipos de PS, y a pesar que a nivel endoscópico e histológico tienen semejanza, existen diferencias tanto a nivel molecular como en su comportamiento biológico. La nomenclatura de los subtipos de PS está en evolución. Actualmente, la Organización Mundial de la Salud (OMS) los clasifica según su estructura histológica en:
- Pólipos hiperplásicos (PH): Son lesiones pequeñas, habitualmente menores a 5 mm, poco elevadas, de coloración similar a la mucosa circundante o blanquecinos por su débil red vascular (a diferencia de los adenomas que son más vascularizados). Se localizan principalmente en recto-sigma. Conservan una arquitectura normal, la característica principal del PH es un patrón aserrado de la superficie epitelial en la mitad superior de la cripta, sumado a la ausencia de displasia citológica (9). Existen 2 tipos histológicos: microvesicular y de células caliciformes, asociándose el primero a mayor riesgo de malignización.
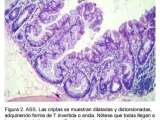
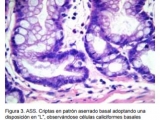
- Adenomas serrados sésiles (ASS): Macroscópicamente son lesiones planas o poco elevadas, de tamaño mayor a 5 mm, predominan en el colon proximal y muchas veces pasan desapercibidas en los estudios endoscópicos. Al igual que los PH, histológicamente presentan un patrón epitelial en dientes de sierra, pero éstos presentan en la base de sus criptas una morfología típica, ya que éstas se encuentran engrosadas y presentan ramificaciones (Fig. 2 y 3) (10). A su vez, éstos pólipos se subclasifican en AAS con o sin displasia dependiendo si presentan cambios de atipia celular.
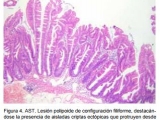
- Adenomas serrados tradicionales (AST): Al igual que los anteriores, presenta una morfología aserrada, pero se distinguen por presentar células hipereosinofílicas ubicadas en extensiones lineales perpendiculares al eje mayor de la cripta (Fig. 4). Éste fenómeno se denomina “formación ectópica de criptas” (8). Estos pólipos, en semejanza a los AAS, pueden presentar displasia (Fig. 2). El estudio genético de estos pólipos ha demostrado que pueden presentar mutaciones de los genes K-ras o BRAF, existiendo mutaciones (combinadas) en hasta el 75 % de los casos (11).
Los “pólipos serrados grandes” (LSPs) son aquellos con un tamaño superior a los 10 mm de diámetro. Se considera “adenoma serrado avanzado” a aquel que mide más de 10 mm de diámetro, que tiene en su histología componente tubulovelloso o velloso, con displasia de alto grado o carcinoma intramucoso o cualquier combinación de los anteriormente descriptos.
Las lesiones descriptas pueden presentarse de manera aislada, o conformar síndromes llamados de “poliposis serrada”, los cuales se agrupan según criterios de la OMS en 3 grupos: 1) al menos 5 pólipos serrados proximales al sigma; 2) cualquier número de pólipos serrados proximales al sigma, en un paciente con antecedentes familiares de poliposis serrada; 3) más de 20 pólipos serrados independientemente de su localización en el colon (12).
La edad media de diagnóstico de este síndrome es de 52 años. La importancia de su reconocimiento como entidad recae en que tanto los pacientes que lo presenten como sus familiares tienen riesgo mayor que la población general de desarrollar CCR, teniendo éstos últimos hasta 5 veces más probabilidades de desarrollar una neoplasia colónica. A nivel molecular el ASS también parece ser una entidad diferente. Se ha detectado una mayor frecuencia de inestabilidad de microsatélites (IMS) en los ASS que en los PH o en los AST. Los ASS muestran una mayor frecuencia de metilación de las islas CpG que los PH convencionales, mientras que respecto a los adenomas tradicionales tienen una mayor frecuencia de mutaciones en el gen BRAF y una menor frecuencia de mutaciones en el gen K-ras (13).
Epidemiología
De los anteriores, el pólipo más frecuente es el PH, representando entre un 70%-95% de los pólipos serrados (14). Generalmente, aparecen en el colon izquierdo, preferentemente a nivel recto-sigma. Los ASS representan entre 5-25% (14), y a diferencia de los PH se presentan más en el colon derecho. Por último, los AST son mucho menos frecuentes, representando alrededor del 1% de las lesiones serradas del colon, apareciendo predominantemente en el colon izquierdo a nivel distal (recto-sigma) (14).
Los factores de riesgo asociados a la aparición de estas lesiones son comunes a la de los adenomas tradicionales e incluyen factores genéticos y ambientales. Dentro de los últimos se encuentran la obesidad, el consumo de tabaco y factores asociados a la dieta como el consumo de carnes rojas, grasas y altas cantidades calóricas (15). Los antecedentes familiares de pólipos tendrían una mayor influencia en la aparición de PS en el lado derecho del colon.
A su vez, agregándose a los casos de pólipos esporádicos, se agrega una entidad reconocida como el síndrome de poliposis serrada (SPS) familiar, antes denominado síndrome de poliposis hiperplásica. Se cree que existe predisposición genética con mutaciones en los genes MUTYH, y se ha comprobado alta relación con el hábito tabáquico. La multiplicidad de las lesiones, el tamaño y la edad temprana de diagnóstico hacen que el riesgo de CCR sea 5 veces superior en los familiares de primer grado. La edad promedio de diagnóstico varía entre los 50-60 años. Macroscópicamente se caracteriza por la presencia de múltiples pólipos serrados en el colon, de gran tamaño (mayores a 10 mm). Se estima una incidencia de aproximadamente 1 /3000 casos pero son pocos los casos confirmados por la dificultad en la detección endoscópica de los mismos y por la falta de consenso de los anatomopatólogos para diagnosticarlos. Dentro del SPS se reconocen 3 fenotipos diferentes: proximal, distal y mixto, siendo en parte los factores ambientales como el tabaquismo y el sobrepeso parcialmente responsables de estas diferencias fenotípicas. Pese a las mismas, no existe mayor riesgo de desarrollo de CCR en función del fenotipo. Por otro lado, es muy frecuente la presencia de adenomas sincrónicos en los pacientes con SPS (hasta en el 70% de los casos). A diferencia de la poliposis adenomatosa familiar (PAF), no existe un riesgo aumentado de lesiones gastroduodenales o neoplasias extracolónicas en el SPS (2). Es importante destacar que los adenomas convencionales pueden “coexistir” junto a los pólipos serrados en estos pacientes (6).
Consideraciones clínicas
A pesar de que mucho se ha avanzado en los conocimientos que rodean a esta entidad, aún no es claro si los PS (especialmente los AAS) progresan igual o más velozmente a neoplasia colónica que los adenomas convencionales. La evidencia apunta que la vía serrada de la carcinogénesis puede progresar a malignidad rápidamente, existiendo casos en los que se ha reportado la progresión de adenoma serrado-carcinoma en plazos cercanos a los 3 años (16). Éste tipo de comportamiento podría explicar cómo ciertos tumores crecen en el intervalo entre 2 colonoscopías de screening, conformando los denominados cánceres de intervalo.
De hecho, estudios genéticos sobre los tumores extirpados de pacientes que han padecido CCR de intervalo, han demostrado tener IMS y otros sellos moleculares reconocidos en los ASS, vinculando así estos dos fenómenos. Por otro lado, es sabido que los ASS tienen menos tendencia a sangrar microscópicamente, por lo que la sangre oculta en materia fecal no tendría utilidad en la detección de estas lesiones en estadios tempranos (18).
Apoyando esta teoría, existe evidencia que ha demostrado que los cánceres de intervalo son hasta 3 veces más comunes en el hemicolon derecho, coincidiendo con el sitio donde asientan con más frecuencia los ASS. (19).
Se sabe que existe relación comprobada entre la presencia de PS y neoplasia colónica metacrónica. Existen distintos estudios que evalúan el riesgo de neoplasia sincrónica en estos pacientes, demostrando que existe 2 veces más riesgo sobre todo en PS grandes mayores a 10 mm (LPSs) y en aquellos de localización proximal(17).
Diagnóstico
Por la morfología predominantemente plana, los estudios radiológicos como el enema colónico con bario y la colono-TAC no tienen sensibilidad ni especificidad suficientes para descartar estas lesiones. A diferencia de los estudios radiológicos, la colonoscopía tiene un rol fundamental y es el método de elección para el diagnóstico y tratamiento de los PS (19). El aspecto endoscópico visualizado durante la colonoscopía también difiere de los adenomas clásicos, motivo por el cual estas lesiones pueden pasar desapercibidas en estudios de screening, como se nombró anteriormente (Fig. 1). Típicamente, los PH son lesiones menores de 5 mm, ligeramente sobreelevados y predominan en el colon izquierdo a nivel rectosigmoideo (14). Estos pólipos tienen muy escasa probabilidad de malignizar. Por el contrario, los ASS tienden a ser de mayor tamaño y al momento del estudio el 50% de ellos tendrá un tamaño mayor a 10 mm. La mayoría de ellos se encuentra en el colon derecho. El color y la superficie de los PS se asemejan mucho a la mucosa colónica normal, teniendo como característica la presencia de mucus adherido en su superficie que oculta la lesión. Debido a ello, es fundamental que el endoscopista busque estas lesiones de manera activa, especialmente en colon derecho (20). Cuando se utilizan endoscopios de alta resolución con polarización de imágenes (narrow band imaging – NBI), las lesiones resaltan de un color rojizo, haciéndolas más visibles durante la exploración. Por último, los AST son más simples de identificar, ya que se presentan generalmente como pólipos de base ancha o subpediculados en el recto-sigma, de tamaño mayor a 10 mm, por lo que rara vez pasan desapercibidos.
Manejo
De todos los tipos de PS mencionados anteriormente se recomienda extirpación completa, excepto de los pólipos hiperplásicos de 5 mm o menos alojados en sigmoides ya que no se ha demostrado incremento de CCR con éste tipo de lesiones (4). Posterior a la resección del PS, deben realizarse colonoscopías de seguimiento dependiendo del tamaño, número de pólipos en la colonoscopía inicial, y las características anatomopatológicas de la lesión (con o sin displasia), ajustándolo a cada caso. Si se trata de lesiones grandes y existen dudas de si la resección fue completa, se sugiere nueva colonoscopía con cromoendoscopía a los 3-6 meses del procedimiento. En caso de que exista imposibilidad de manejo endoscópico debido al tamaño de la lesión, ubicación, o si se trata de lesiones múltiples en contexto de una SPS, estará indicada la resección quirúrgica (colectomía total) (21).
Los familiares de primer grado deberían realizar colonoscopías cada 1-2 años, e iniciar 10 años antes del familiar afectado más joven (6).
Síndrome de poliposis serrada: El manejo de esta patología debe ser integral incluyendo resección de pólipos, vigilancia endoscópica periódica y consejo genético (2). Ante el hallazgo de CCR, se recomienda la colectomía total por el riesgo que tienen estos pacientes de neoplasias metacrónicas como se nombró anteriormente. Posterior a la cirugía, el control endoscópico del recto remanente debe ser semestral o anual, individualizado para cada caso, con el objetivo de resecar los pólipos remanentes. En cuanto al consejo familiar, deben realizarse endoscopías de control a todos los familiares de primer grado que presenten SPS, a partir de los 35-40 años, o 10 años antes del diagnóstico del caso más joven dentro de la familia (22).
Conclusión
Los PS representan un grupo heterogéneo de lesiones que tienen en común a nivel histológico la disposición en dientes de sierra de las células de superficie de sus criptas. Durante los últimos años, la evidencia ha demostrado que su comportamiento no es siempre benigno como se pensaba, presentando potencial de malignización y progresión a CCR siguiendo vías genéticas denominadas “vías serradas de la carcinogénesis”, las cuales aún están en estudio y no se conocen con exactitud. Lo anterior exige que los PS deban ser buscados activamente mediante colonoscopía y removidos de forma completa, aunque debido a su morfología plana y su color pálido pueden no ser detectados en endoscopías de screening o vigilancia, más aún en aquellos pacientes con inadecuada preparación colónica.
Aunque aún no se ha diseñado una estrategia uniforme, es de cabal importancia el adecuado seguimiento posterior a la resección de los PS, ya que se ha sugerido que el tiempo necesario para la malignización de estas lesiones es menor que la de los adenomas tradicionales. El reconocimiento de la vía serrada ha significado un gran avance en el entendimiento de la biología del CCR, explicando en parte la aparición de los cánceres de intervalo.
La poliposis serrada se caracteriza por presentar múltiples pólipos serrados sincrónicos. Su diagnóstico reside en el cumplimiento de los criterios clínicos mencionados, y el manejo de los pacientes que lo presenten debe ser multidisciplinario, integrando cirujanos, genetistas y gastroenterólogos.
Bibliografía
1. Fuente: SIVER/INC–Ministerio de Salud de la Nación en base a registros de mortalidad de la DEIS-Argentina, 2016.2. Carballal S, Moreira L, Balaguer F. Pólipos serrados y síndrome de poliposis serrada. Cir Esp 2 0 1 3; 9 1: 1 4 1- 8.
3.Leggett B, Whitehall V. Role of the serrated pathway in colorectal cancer pathogenesis. Gastroenterology. 2010;138:2088–100.
4.Moreira L. Serrated polyps: detection, risk of colorectal cancer and treatment and surveillance strategies. Gastroenterol Hepatol. 2011;34 Suppl 2:73-7.
5.Torlakovic E, Skovlund E, Snover DC, Torlakovic G, Nesland JM. Morphologic reappraisal of serrated colorectal polyps. Am J Surg Pathol. 2003;27:65-81.
6. Bujanda Luis. Serrated polyposis síndrome: Molecular, pathological and clinic aspects. Word J Gastroenterol 2012; 18:2452-61.
7.Fischer C, Pereyra L, Gonzales R, Casas G. Prevalencia de adenomas serratos de colon y asociación con lesiones neoplásicas sincrónicas y metacrónicas. Acta Gastroenterol Latinoam 2012;42:92-8.
8. Leggett B, Whitehall V. Role of the serrated pathway in colorectal cancer pathogenesis. Gastroenterology 2010; 138:2088-100.
9. Li SC, Burgart L. Histopathology of serrated adenoma, its variants, and differentiation from conventional adenomatous and hyperplastic polyps. Arch Pathol Lab Med 2007;131:440-5.
10. Torlakovic E, Skovlund E, Snover DC, et al. Morphologic reappraisal of serrated colorectal polyps. Am J Clin Pathol 2003;27: 65-81.
11. Fu B, Yachida S, Morgan R, Zhong Y, Montgomery E, Iacobuzio-Donahue C. Clinicopathologic and genetic characterization of traditional serrated adenomas of the colon. Am J Clin Pathol 2012;138:356-66.
12. Jass JR. Hyperplastic polyps and colorectal cancers: is there a link? Clin Gastroenterol Hepatol 2004; 2: 1-8.
13. Snover DC, Ahnen D, Burt R, et al. Serrated polyps of the colon and rectum and serrated polyposis. In: Bosman FT, Carneiro F, Hruban RH. (eds). WHO classification of tumours of the digestive system. 4th ed. Lyon: IARC, 2010.
14. Carr N, Mahajan H, Tan KL, Hawkins N, Ward R. Serrated and non-serrated polyps of the colorectum: their prevalence in an unselected case series and correlation of BRAF mutation analysis with the diagnosis of sessile serrated adenoma. J Clin Pathol 2009;62:516-8.
15. Wallace K, Grau MV, Ahnen D, Snover DC, Robertson DJ, Mahnke D et al. The association of lifestyle and dietary factors with the risk for serrated polyps of the colorectum. Cancer Epidemiol Biomarkers Prev 2009;18:2310-7.
16. Jass JR. Hyperplastic polyps of the colorectum: innocent or guilty? Dis Colon Rectum 2001;44:163-6.
17. Qinyan Gao, Kelvin K.E. Tsoi, Hoyee W. Hirai, Marin C.S. Wong, Francis K.L. Chan, Justin C.Y., James Y.W. Lau, Joseph J.Y. Sung and Siew C. Ng. Serrated polyps and the risk of synchronous colorectal advanced neoplasia: A systemic review and meta – analysis. Am J Gastroenterol 2015: 110:501-9.
18. East JE, Saunders BP, Jass JR. Sporadic and syndromic hyperplastic polyps and serrated adenomas of the colon: classification, molecular genetics, natural history, and clinical management. Gastroenterol Clin North Am 2008;37:25–46.
19. Sawhney MS, Farrar WD, Gudiseva S, Nelson DV, Lederle FA, Rector TS et al. Microsatellite instability in interval colon cancers. Gastroenterology 2006;131:1700-5.
20. Kambara T, Simms LA, Whitehall VL, Srping KJ, Wynter CVA, Walsh MD, et al. BRAF mutation is associated with DNA methylation in serrated polyps and cancers of the colorectum. Gut 2004;53:1137-44.
21. Rex DK, Ahnen DJ, Baron JA, Batts KP, Burke CA, Burt RW, et al. Serrated lesions of the colorectum: review and recommendations from an expert panel. Am J Gastroenterol. 2012;107:1315–29.
22. Boparai KS, Mathus-Vliegen EM, Koornstra JJ, Nagengast FM, van Leerdam M, van Noesel CJ, et al. Increased colorectal cancer risk during follow-up in patients with hyperplastic polyposis syndrome: a multicentre cohort study. Gut. 2010;59:1094–100.